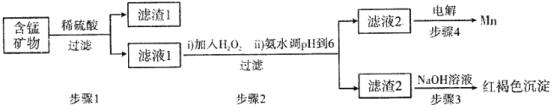
-
水垢的主要成分包括CaCO3、CaSO4等,下列说法错误的是
A.容易产生水垢的水-般是硬水
B.盐酸去除水垢的能力比醋酸更好
C.可用小苏打去除电水壶中的水垢,因为小苏打溶液显酸性
D.水垢中的CaSO4可先用Na2CO3溶液浸泡,再用酸去除
难度: 中等查看答案及解析
-
乐山盛产西红柿,常温下某鲜榨西红柿汁的pH=3,则c(H+ )为
A.3 mol/L B.0. 003 mol/L C.1×10-11 mol/L D.1×10-3 mol/L
难度: 简单查看答案及解析
-
下列能量的转化过程中,由化学能转化为电能的是
A.车载铅蓄电池启动 B.夹江千佛岩电站水力发电
C.西藏拉萨太阳能发电 D.新疆吐鲁番风力发电
难度: 简单查看答案及解析
-
下列叙述中与盐类水解有关的是
A.自来水杀菌、消毒
B.实验室制H2时,在稀H2SO4溶液中滴入少许CuSO4溶液
C.不能用玻璃瓶盛放NH4F浓溶液
D.酸雨在空气中放置一段时间后,pH降低
难度: 中等查看答案及解析
-
某同学在实验报告中记录了下列数据,其中正确的是
A.用托盘天平称取5.85 g食盐
B.用10 mL量筒量取7.35 mL盐酸
C.用广泛pH试纸测出某溶液pH为3.5
D.从酸式滴定管放出酸性KMnO4溶液15.60 mL
难度: 简单查看答案及解析
-
具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式如图,它属于( )
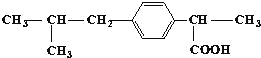
①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
A.③⑤ B.②③ C.①③ D.①④
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.在强碱性溶液中:Na+、K+、AlO
 、CO
、CO
B.由水电离出的c(H+)=1×10–l4 mol/L的溶液中:Ca2+、C1-、HCO
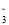 、K+
、K+C.显中性的溶液中:Fe3+、Na+、C1-、SO
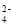
D.在含大量Fe2+的溶液中:NH
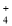 、Na+、C1-、[Fe(CN)6]3-
、Na+、C1-、[Fe(CN)6]3-难度: 中等查看答案及解析
-
下列除去杂质的方法中正确的是
A.除去溴苯中的溴:加入CCl4后分液
B.除去苯甲酸中的NaCl:重结晶
C.除去乙烷中的乙烯:加入氢气后在一定条件下充分反应
D.除去乙醇中的乙酸:加入NaOH溶液后分液
难度: 中等查看答案及解析
-
下列用于解释事实的方程式书写不正确的是
A.0.1mol/L氨水的pH约为11:NH3·H2O⇌NH
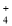 +OH-
+OH-B.用明矾[KAl(SO4)2·12H2O]作净水剂:A13++3H2O⇌Al(OH)3(胶体) +3H+
C.向K2Cr2O7溶液中滴加少量浓H2SO4溶液橙色加深:Cr2O
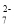 (橙色) +H2O⇌2CrO
(橙色) +H2O⇌2CrO (黄色)+2H+
(黄色)+2H+D.向AgCl悬浊液加入KBr溶液,有淡黄色沉淀生成:Ag++ Br-=AgBr↓
难度: 中等查看答案及解析
-
下列有关电化学在生产、生活中的应用分析正确的是
A.图1:铁钉发生析氢腐蚀 B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变 D.图4:将输油管与电源负极相连可以防止腐蚀
难度: 中等查看答案及解析
-
常温下,下列溶液的粒子浓度关系式正确的是
A.0.1 mol/L的NaHCO3溶液中:c(Na+)>c(HCO
 )>c(CO
)>c(CO )>c(H2CO3)
)>c(H2CO3)B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a>b+1
C.pH=2的H2SO3溶液与pH=12的NaOH溶液等体积混合:c(Na+) +c(H+)=c(OH-) +c(HSO
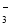 )+2c(SO
)+2c(SO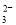 )
)D.0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
将Na2CO3溶液由0.1mol/L稀释到0.01mol/L,测溶渡pH
溶液pH变小
稀释后CO32-的水解程度减小
B
向一定浓度的CuSO4溶液中通入适量的H2S气体
出现黑色沉淀
H2S的酸性比H2SO4强
C
将盛有棕红色NO2气体的注射器由10 mL 压缩至5 mL
气体颜色比压缩前变浅
反应2NO2
 N2O4向右移动
N2O4向右移动D
在新生成的AgCl 沉淀中滴入稀KI溶液,振荡
白色沉淀转化为黄色沉淀
Ksp (AgCl )>Ksp (AgI)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
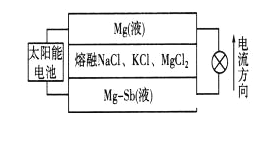
下列说法不正确的是
A.放电时,Mg(液)层的质量减小
B.放电时.正极反应为:Mg2++2e-=Mg
C.该电池充电时,Mg—Sb(液)层发生还原反应
D.该电池充电时,C1- 有向下层移动的趋势
难度: 中等查看答案及解析
-
青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:
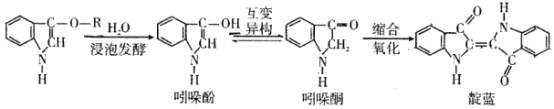
下列说法不正确的是
A.吲哚酚的苯环上的一氯代物有2种
B.靛蓝的分子式为C16H10N2O2
C.1 mol吲哚酮与H2加成时可消耗4 mol H2
D.浸泡发酵过程发生的反应为取代反应
难度: 中等查看答案及解析
-
常温下,向20 mL某浓度的盐酸溶液中滴入0.1 mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图所示,下列分析不正确的是
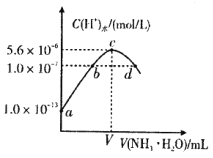
A.该盐酸的浓度为0.1 mol/L
B.b点所示溶液中:c(NH
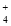 )=c(Cl-)
)=c(Cl-)C.V=20
D.c点所示溶液中:c(H+)-c(OH-)=c(NH3∙H2O)
难度: 中等查看答案及解析
-
下列图示与对应的叙述符合的是( )
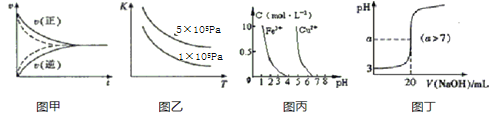
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g)
 2SO3(g)的平衡常数K与温度和压强的关系
2SO3(g)的平衡常数K与温度和压强的关系C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右
D.图丁表示常温下向20mL0.001mol/L的醋酸溶液中滴加0.001mol/L的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
难度: 中等查看答案及解析
 的系统命名为_______。
的系统命名为_______。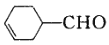 中的官能团名称为_______ 。
中的官能团名称为_______ 。 的1H-核磁共振谱图中有______组特征峰。
的1H-核磁共振谱图中有______组特征峰。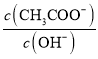 保持增大的是_______。
保持增大的是_______。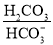 )维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,
)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,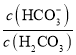 ≈
≈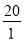 ,1g2=0.3。由题给数据可算得正常人体血液的pH约为_______,当过量的酸进入血液中时,血液缓冲体系中
,1g2=0.3。由题给数据可算得正常人体血液的pH约为_______,当过量的酸进入血液中时,血液缓冲体系中