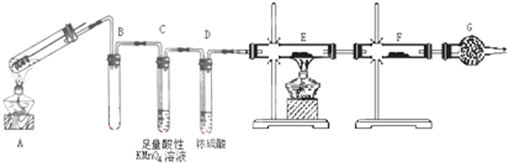
-
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-.分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
A.Na+
B.SO42-
C.Ba2+
D.NH4+难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表IIA族
B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同难度: 中等查看答案及解析
-
向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是( )
A.K+、Br-、CO32-
B.Al3+、H+、MnO4-
C.NH4+、Fe3+、SO42-
D.Ag+、Cu2+、NO3-难度: 中等查看答案及解析
-
下列关于“化学与健康”的说法不正确的是( )
A.“血液透析”利用了胶体的性质
B.食用一定量的油脂能促进人体对某些维生素的吸收
C.服用铬含量超标的药用胶囊会对人对健康造成危害
D.光化学烟雾不会引起呼吸道疾病难度: 中等查看答案及解析
-
下列说法正确的是( )
A.原子晶体中只存在非极性共价键
B.金属元素和非金属元素形成的化合物一定是离子化合物
C.干冰升华时,分子内共价键会发生断裂
D.稀有气体形成的晶体属于分子晶体难度: 中等查看答案及解析
-
下列有关钠的叙述中,错误的是( )
A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C.钠是一种灰黑色的固体
D.钠的质地软,可用小刀切割难度: 中等查看答案及解析
-
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO(g);△H=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(g);△H=+571.6kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ/mol
D.C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400kJ/mol
难度: 中等查看答案及解析
-
设阿伏加德罗常数的数值为NA,下列说法正确的是( )
A.1molCl2与足量Fe反应,转移的电子数为3NA
B.2mol Na2O2 与足量H2O反应,转移的电子数为4NA
C.常温常压下,78g的Na2O2 晶体中所含阴离子数为2NA
D.0.10mol Na与Li的合金跟足量水反应生成H2的分子数为0.05NA难度: 中等查看答案及解析
-
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
A.O3+2KI+H2O═2KOH+I2+O2
B.2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2
C.I2+2NaClO3═2NaIO3+Cl2
D.2HCl+2Na═2NaCl+H2↑难度: 中等查看答案及解析
-
某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成.使该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定).若将原混合物粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合物粉末的质量.下列判断正确的是( )
①粉末中一定含有Na2O、Na2O2和NaHCO3
②粉末中一定不含有Na2CO3和NaCl
③粉末中一定不含有Na2O和NaCl
④无法肯定粉末中是否含有Na2CO3和NaCl.
A.①③
B.②④
C.①④
D.②③难度: 中等查看答案及解析
-
下列离子方程式中错误的是( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH稀溶液反应:NH4++OH-═NH3•H2O
C.在澄清石灰水中通入过量二氧化碳 OH-+CO2=HCO3-
D.Fe跟少量盐酸的反应:Fe+2H+═Fe2++H2↑难度: 中等查看答案及解析
-
已知用金属钠制取氧化钠的方法有许多,下列方法最好且解释合理的是( )
A.4Na+O2(纯)2Na2O 产物唯一,条件易控制
B.4Na+CO22Na2O+C 原料价廉,反应操作简便
C.2NaNO2+6Na4Na2O+N2↑ 产物中只有Na2O固体生成,且生成的N2可将周围环境中的O2排净,保护Na2O不被进一步氧化
D.4Na+O2(空气)2Na2O 操作简便
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用.已知某镍镉电池中电解质溶液为KOH溶液,其充放电按下式进行:Cd+2NiOOH+2H2O
Cd(OH)2+2Ni(OH)2,有关该电池的说法错误的是( )
A.充电时阳极反应:Ni(OH)2+OH-+e-→NiOOH+H2O
B.充电过程是电能转化为化学能的过程
C.放电时负极上发生氧化反应,电极附近溶液的碱性减弱
D.放电时电解质溶液中OH-向负极移动难度: 中等查看答案及解析
-
氢气、一氧化碳、辛烷(C8H18)、甲烷燃烧的热化学方程式分别为:
H2(g)+O2(g)=H2O(l);△H=-285.8kJ/mol
CO(g)+O2(g)=CO2(g);△H=-282.6kJ/mol
C8H18(l)+O2(g)=8CO2(g)+9H2O(l);△H=-5472kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-889.6kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最多的是( )
A.H2(g)
B.CO(g)
C.C8H18(l)
D.CH4(g)难度: 中等查看答案及解析
-
如图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O.下列说法正确的是( )
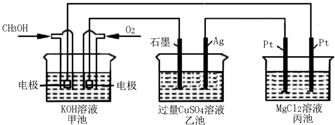
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体难度: 中等查看答案及解析
-
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是( )
50mL盐酸 50mL盐酸 50mL盐酸 m(混合物) 9.2g 15.7g 27.6g V(CO2)(标准状况) 2.24L 3.36L 3.36L
A.盐酸的物质的量浓度为3.0 mol•L-1
B.能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2 g 时盐酸未反应完
D.15.7 g 混合物恰好与盐酸完全反应难度: 中等查看答案及解析