-
化学与生活密切相关,下列说法错误的是
A. 盐卤点豆腐,明矾净水和利用电泳来分离各种氨基酸和蛋白质都与胶体的性质有关
B. 人工制造的铝硅酸盐分子筛可用作吸附剂和催化剂载体
C. 生物柴油可以用廉价油脂与甲醇发生酯交换反应制得,属于不可再生能源
D. 在建的国产航母采用了新的防腐蚀技术,传统的船舶防腐蚀技术是在船体上焊接一些锌块,原理是采用牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 标准状况下,44.8LNO与22.4O2反应后的分子数是2 NA
B. 常温下,7.8g苯中所含碳碳双键数目为0.3NA
C. 27g铝中加入足量的1mol·L-1NaOH溶液,转移电子数是3NA
D. 25℃时,1.0LpH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA
难度: 中等查看答案及解析
-
进行化学实验、观察实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列说法正确的是
A. 证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉一KI试纸检验,观察试纸颜色的变化
B. SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出气体和SO2的体积比为2∶3
C. 验证淀粉水解产物是否具有还原性,取水解液于试管中加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
D. 在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,该过程中总反应为2A1 +3Ag2S==6Ag + Al2S3
难度: 困难查看答案及解析
-
有M、A 、B、D、N、E六种短周期元素原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
A. 沸点:M2D > BM3 > AM4 B. 原子半径:rE>rA>rB >rD
C. 化合物AnM2n分子中既含有极性鍵又含有非极性鍵 D. B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
难度: 困难查看答案及解析
-
化合物X是一种黄酮类化合物的中间体,其结构简式如图所示。下列有关化合物X的说法正确的是
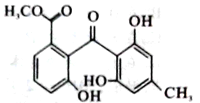
A. 化合物X分子式为C16H12O6
B. 化合物X含有醚健、羰基,羟基三种官能团
C. lmol化合物X最多可与4mol Br2发生反应
D. lmol化合物X最多能与3mol NaOH反应
难度: 困难查看答案及解析
-
依据下表25℃时某些弱酸的电离平衡常数,判断下列说法正确的是
CH3COOH
HC1O
H2CO3
Ka=1.8×l0-5
Ka=3.0×l0-8
Ka1=4.4×l0-7 Ka2=4.7×l0-11
A. 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O==2HC1O+CO32-
B. 相同浓度的CH3COOH和NaClO的溶液中,水的电离程度前者大
C. 向0. lmol • L-l的CH3COOH溶液中滴加NaOH溶液至pH = 5,此时溶液的 c(CH3COOH):c(CH3COO-) =5∶9
D. 常温下,0• lmol • L-1 的 NaHC2O4 溶液 pH =4: c(HC2O4-) >c(H+)>c(H2C2O4)>c(C2O42-)
难度: 困难查看答案及解析
-
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
CH3OH(g)。 一定条件下,将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是
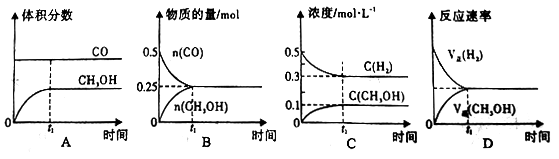
A. A B. B C. C D. D
难度: 困难查看答案及解析


 ),其分子中σ键和π键的个数比是____________;
),其分子中σ键和π键的个数比是____________;
 ____________【已知HCHO是所有醛中还原性最强的,与乙醛在稀碱作用下能连续发生类似反应③的加成反应,在Ca(OH)2和HCHO催化作用下可将其他醛还原为醇】。
____________【已知HCHO是所有醛中还原性最强的,与乙醛在稀碱作用下能连续发生类似反应③的加成反应,在Ca(OH)2和HCHO催化作用下可将其他醛还原为醇】。