-
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
A.原子半径由小到大的顺序:X<Y<Z<W
B.Z的最高价氧化物能与水反应生成相应的酸
C.Y单质在一定条件下可以与氧化铁发生置换反应
D.室温下,0.1 mol/L W的气态氢化物的水溶液的pH>1难度: 中等查看答案及解析
-
锂经常被用来做锂电池,有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S,已知亚硫酰氯和AlCl3•6H2O混合共热蒸干,可制得无水AlCl3.则下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4:1难度: 中等查看答案及解析
-
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-═Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.直径介于1nm~10nm之间的微粒称为胶体
B.电泳现象可证明胶体属于电解质溶液
C.利用丁达尔效应可以区别溶液与胶体
D.胶体粒子很小,可以透过半透膜难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中不正确的是(忽略混合前后溶液体积变化)( )
A.溶液的pH值:②>③>①
B.水电离出的c(OH-):③>①>②
C.①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)难度: 中等查看答案及解析
-
下列各组离子能大量共存的是( )
①“84”消毒液的水溶液中:Fe2+、Cl-、Ca2+、Na+
②加入KSCN显红色的溶液:K+、NH4+、Cl-、S2-
③能够与金属Cu常温下反应放出气体的溶液;Fe3+、Al3+、SO42-、K+
④pH=2的溶液中:NH4+、Na+、Cl-、Cu2+
⑤无色溶液中:K+、CH3COO-、HCO3-、MnO4-.
A.②③
B.①③
C.①⑤
D.③④难度: 中等查看答案及解析
-
人体内产生的活性氧能加速人体衰老,被称为“生命杀手”.化学家尝试用Na2SeO3消除人体内活性氧,Na2SeO3在人体内的作用是( )
A.抗氧化剂
B.抗还原剂
C.抗酸剂
D.抗碱剂难度: 中等查看答案及解析
-
下列化合物的一氯代物的数目排列顺序正确的是( )
①CH3CH2CH2CH2CH2CH3
②(CH3)2CHCH(CH3)2
③(CH3)3CCH2CH3
④(CH3)3CC(CH3 )3 .
A.①>②>③>④
B.②>③=①>④
C.③>②>④>①
D.③=①>②>④难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
①同一元素的不同核素互称为同位素
②化学键可以使离子相结合,也可以使原子相结合
③金属腐蚀的实质是金属原子失去电子被还原的过程
④Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关
⑤铅蓄电池在放电过程中,负极质量减少,正极质量增加
⑥Al和Fe在一定条件下都能与某些氧化物反应
⑦干冰和氨都属于弱电解质
⑧汽油和花生油的主要成份都是油脂.
A.①③④⑦⑧
B.②③④⑤⑧
C.③④⑤⑦⑧
D.①③⑤⑥⑦难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小一定越容易失去电子
C.稀有气体元素的原子序数越大,其单质的熔、沸点一定越高
D.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高难度: 中等查看答案及解析
-
下列实验方案不能达到预期目的是
选项 实验方案 预期目的 A 将含有HCl的CO2气体通过饱和NaHCO3溶液 除去CO2中的HCl B 向X溶液中滴加盐酸酸化的BaCl2溶液 检验X溶液中是否含有SO42- C 向醋酸钠溶液中滴入酚酞试液,加热后若红色加深 证明盐类的水解是吸热的 D 向含有少量苯酚的苯中加入NaOH溶液,振荡、静置、分液 除去苯中的苯酚
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.1.00 L 1.00 mol•L-1盐酸中含有6.02×1023个HCl分子
B.25℃、101 kPa下,42 g N2和CO混合气体中含有的原子数为3NA
C.11.2 L C02含有的分子数为O.5NA
D.配制1.0 L 1.0 mol•L-1的CuSO4溶液,可将250.0 g CuSO4•5H2O溶于1.0 L水难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A.有机化合物中每个碳原子最多形成4个共价键
B.油脂、淀粉、蛋白质在一定条件下都能发生水解反应
C.用溴水既可以鉴别甲烷和乙烯,也可以除去甲烷中的乙烯
D.乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,下列关系正确的是( )
A.原子半径:W>Y
B.离子半径:Y2-<Z-
C.热稳定性:H2Y>HZ
D.碱性:W(OH)3>XOH难度: 中等查看答案及解析
-
以下实验原理或操作中,正确的是( )
A.分液操作中,待下层液体流出后,再将上层液体从分液漏斗下口放出
B.焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧
C.中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果
D.测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较难度: 中等查看答案及解析
-
第三周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2molECln与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀.下列判断错误的是( )
A.E是一种非金属元素
B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2
D.E位于元素周期表的IVA族难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
①向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④碳酸钠水【解析】
CO32-+2H2O⇌H2CO3+2OH-
⑤向氢氧化钡中滴加硫酸:Ba2++SO42-+H++OH-=BaSO4+H2O
⑥次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦氯化铝的溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
⑧氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
⑨纯碱溶液中滴加少量盐酸:CO32-+H+=HCO3-.
A.①②⑤⑨
B.②③⑨
C.④⑤⑥⑦
D.②③⑧⑨难度: 中等查看答案及解析
-
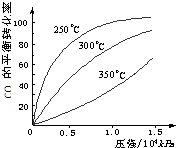
根据碘与氢气反应的热化学方程式,下列判断正确的是( )
①I2(g)+H2(g)⇌2HI(g)+9.48kJ
②I2(S)+H2(g)⇌2HI(g)-26.48kJ.
A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.当反应②吸收52.96kJ热量时转移2mole-
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘比1 mol气态碘所含能量多了17.00 kJ难度: 中等查看答案及解析
-
用来表示可逆反应:2A(g)+B(g)≒2C(g) (△H>0)的正确图象( )
A.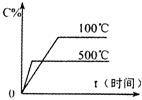
B.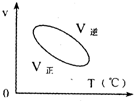
C.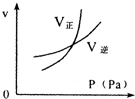
D.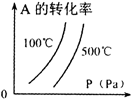
难度: 中等查看答案及解析
-
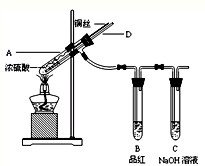
由化学能转变的热能或电能仍然是人类使用的主要能源.根据如图所示的装置,判断下列说法不正确的是( )
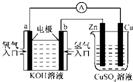
A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e-═2H2O
D.该装置中a极为正极,发生氧化反应难度: 中等查看答案及解析
-
膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
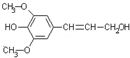
A.芥子醇的分子式是C11H14O4,属于芳香烃
B.芥子醇与浓溴水既能发生取代反应又能发生加成反应
C.芥子醇能发生氧化、取代、加成、聚合反应
D.1mol芥子醇能与含2mol NaOH的水溶液完全反应难度: 中等查看答案及解析
-
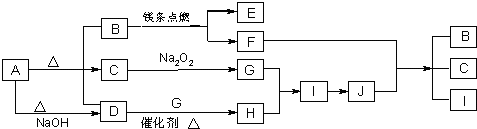
X、Y、Z、W有如图所示的转化关系,则X、W可能是①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2( )
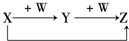
A.①②③
B.①②
C.③④
D.①②③④难度: 中等查看答案及解析
-
将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g•mL-1,该溶液的溶质质量分数为( )
A.%
B.%
C.%
D.%
难度: 中等查看答案及解析
-
某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:
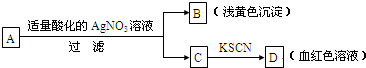
现对A、B、C、D作出的如下推断中,不正确的是( )
A.盐A一定是FeBr3
B.浅黄色沉淀B是AgBr
C.滤液C中一定含Fe3+
D.D溶液中有Fe(SCN)3难度: 中等查看答案及解析