-
下列能量转化过程与氧化还原反应无关的是
A. 硅太阳能电池
B. 锂离子电池放电
C. 火箭的燃料燃烧
D. 葡萄糖提供能量



A. A B. B C. C D. D
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同条件下测得反应速率,其中速率最快的是
A. υ(C)=0.5 mol / L·s B. υ(D)=0.4 mol / L·s
C. υ(B)=0.6 mol / L·s D. υ(A)=0.15 mol / L·s
难度: 中等查看答案及解析
-
下列物质中属于电解质的是
①酒精 ②硫酸铜 ③水 ④醋酸 ⑤镁 ⑥氨水
A. ①②④⑤ B. ②③④ C. ②③④⑥ D. 全部
难度: 简单查看答案及解析
-
在一定温度下的密闭容器中,发生反应:2SO2(g)+O2(g)
2SO3(g),达到平衡状态时缩小容器容积,下列叙述不正确的是
A. 该反应的平衡常数不变 B. 平衡向正反应方向移动
C. SO3的浓度增大 D. 正反应速率增大,逆反应速率减小
难度: 简单查看答案及解析
-
关于常温下pH=12的稀氨水,下列叙述不正确的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水电离出的c (OH-)=1.010-12 mol·L-1
C. 加水稀释后,氨水的电离程度增大
D. 加入少量NH4Cl固体,溶液pH变大
难度: 简单查看答案及解析
-
25℃时,水中存在电离平衡:2H2O
H3O++OH-ΔH>0。下列叙述不正确的是
A. 向水中通入HCl,抑制水的电离
B. 向水中加入少量氨水,促进水的电离
C. 向水中加入少量Na2CO3固体,促进水的电离
D. 将水加热,Kw增大
难度: 简单查看答案及解析
-
100 mL 2 mol/L的盐酸与过量的锌片反应时,为减慢反应速率,又不影响生成的氢气的总量,可采用的方法是
A. 加入适量的6 mol/L的盐酸 B. 加入适量的醋酸钠固体
C. 加入适量的NaOH固体 D. 加入几滴氯化铜溶液
难度: 中等查看答案及解析
-
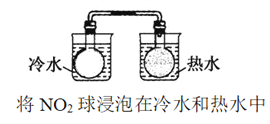
下列事实与对应的方程式不符合的是
A. 自然界中正常的雨水呈酸性:H2O+CO2
H2CO3 ,H2CO3
H++HCO3—
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色)
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热为-890.3 kJ·mol—1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32-+2H+=S +SO2 +H2O
难度: 中等查看答案及解析
-
据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g),下列叙述错误的是
A. 反应需在300 ℃进行可推测该反应是吸热反应
B. 使用催化剂可提高反应速率
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
难度: 中等查看答案及解析
-
对反应2A(g)+2B(g)
3C(g)+D(?),下列图象的描述正确的是

A. 依据图①,若t1时升高温度,则ΔH<0
B. 依据图①,若t1时增大压强,则D是固体或液体
C. 依据图②,P1>P2
D. 依据图②,物质D是固体或液体
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是
A. 90 oC,纯水的pH<7
B. 黄绿色的氯水光照后颜色变浅
C. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
D. 重铬酸钾溶液中滴加氢氧化钠溶液,溶液由橙色变黄色
难度: 中等查看答案及解析
-
反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,有关该反应的下列说法正确的是

A. 每生成2 mol AB分子,需要吸收b kJ热量
B. 加入催化剂,(a-b)的差值减小
C. 该反应的反应物断键吸收的能量大于生成物成键放出的能量
D. 若反应生成AB为液态,每生成2 mol AB分子,需要吸收的热量大于(a-b) kJ
难度: 中等查看答案及解析
-
以下三个反应均可获取O2:
①光催化分解水制氧气:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol—1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196.4 kJ·mol—1
③一氧化氮分解制氧气:2NO(g)=N2(g)+O2(g) ΔH3=-180.5 kJ·mol—1
由此得出的有关推断正确的是
A. ①是热能转化为光能的反应 B. ③在常温下一定可以实际发生
C. ①在高温下可以自发进行 D. ①、②都是熵减少的反应
难度: 中等查看答案及解析
-
下列有关实验内容、实验装置和对应的实验目的均正确的是
A. 测定中和热

B. 比较Cu2+、Fe3+对反应速率的影响
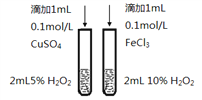
C. 比较醋酸和硼酸的酸性强弱

D. 比较温度对化学反应速率的影响
难度: 中等查看答案及解析
-
β--紫罗兰酮是存在于玫瑰花、番茄等中的一种天然香料,它经多步反应可合成维生素A1。

下列说法正确的是
A. β--紫罗兰酮可使酸性KMnO4溶液褪色
B. 1mol中间体X最多能与2mol H2发生加成反应
C. 维生素A1易溶于NaOH溶液
D. β--紫罗兰酮与中间体X互为同分异构体
难度: 中等查看答案及解析
-
新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—
Cu(OH)42—(深蓝色)。某同学进行下列实验:
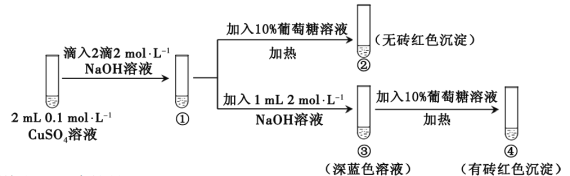
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
难度: 简单查看答案及解析
-
温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生反应PCl5(g)
PCl3(g)+Cl2(g)。反应过程中c(Cl2)随时间变化的曲线如下图所示,下列说法不正确的是

A. 反应在0 ~50 s 的平均速率υ(Cl2)=1.6×10-3 mol/(L·s)
B. 该温度下,反应的平衡常数K=0.025
C. 保持其他条件不变,升高温度,若平衡时c(PCl3)=0.11 mol/L,则该反应的ΔH >0
D. 反应达到平衡后,再向容器中充入1 mol PCl5,该温度下再达到平衡时,c(Cl2)>0.2 mol/L
难度: 中等查看答案及解析
-
某温度下,CO(g)+H2O (g)
CO2(g)+H2(g)的平衡常数K=1。该温度下在体积均为1 L的甲、乙两个恒容密闭容器中,投入CO(g)和H2O(g)的起始浓度及5 min时的浓度如下表所示。
甲
乙
起始浓度
5min时浓度
起始浓度
5min时浓度
c(CO)/mol/L
0.1
0.08
0.2
x
c(H2O)/mol/L
0.1
0.08
0.2
y
下列判断不正确的是
A. x=y=0.16
B. 反应开始时,乙中反应速率比甲快
C. 平衡时,乙中的c(CO)是甲中的2倍
D. 平衡时,乙中H2O的转化率是50%
难度: 中等查看答案及解析
-
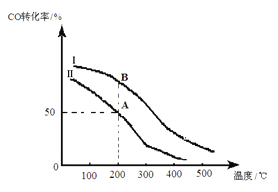
将粗硅转化成三氯硅烷(SiHCl3),进一步反应也可以制得粗硅。其反应为:SiHCl3(g)+H2(g)
Si(s)+3HCl(g)。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是

A. 该反应是放热反应
B. 横坐标表示的投料比应该是
C. 该反应的平衡常数随温度升高而增大
D. 实际生产中为提高SiHCl3的利用率,可以适当增大压强
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
已知反应2CH3OH(g)
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol·L-1)
0.44
0.6
0.6
下列说法正确的是
A. 加入CH3OH的物质的量a=1.64
B. 此时刻正反应速率大于逆反应速率
C. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率减小
D. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
难度: 中等查看答案及解析
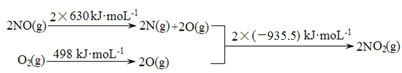
 。
。

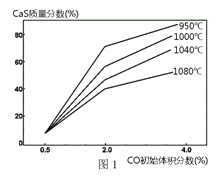
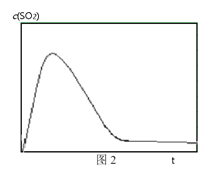
 及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。
及温度的关系,研究小组在10 L的密闭容器中进行模拟反应,并绘出下图。