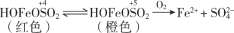-
已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
| 实验 1 | 实验步骤 | 实验现象 |
| ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 |
| ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
| 实验2 | 实验步骤 | 实验现象 |
| ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 |
| ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 |
| ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 |
| ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I- I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
-
为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L−1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L−1。
①用化学用语解释FeCl3溶液呈酸性的原因:_______________________________________。
②下列实验方案中,能使FeCl3溶液pH升高的是_______________________________(填字母序号)。
a.加水稀释 b. 加入FeCl3固体
c.滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
| 操作 | 现象 |
| 向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L−1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________________________________。
② 用离子方程式解释反应后溶液为浅绿色的原因:_______________________________________________________。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是________________________________________。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是__________________。
(3)为进一步探究上述1.0 mol·L−1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
| 操作 | 现象 |
| 将5 mL 1.0 mol·L−1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将___与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L−1 FeCl3溶液中,Fe3+的氧化性比H+更强。
-
为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L−1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L−1。
①用化学用语解释FeCl3溶液呈酸性的原因:_______________________________________。
②下列实验方案中,能使FeCl3溶液pH升高的是_______________________________(填字母序号)。
a.加水稀释 b. 加入FeCl3固体
c.滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
| 操作 | 现象 |
| 向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L−1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:___________________________________。
② 用离子方程式解释反应后溶液为浅绿色的原因:_______________________________________________________。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是________________________________________。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4 , 理由是__________________。
(3)为进一步探究上述1.0 mol·L−1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
| 操作 | 现象 |
| 将5 mL 1.0 mol·L−1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将___与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L−1 FeCl3溶液中,Fe3+的氧化性比H+更强。
-
某实验小组对FeCl3分别与Na2SO3、NaHSO3的反应进行探究。
(甲同学的实验)
| 装置 | 编号 | 试剂X | 实验现象 |
| 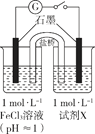
| I | Na2SO3溶液(pH≈9) | 闭合开关后灵敏电流计指针发生偏转 |
| II | NaHSO3溶液(pH≈5) | 闭合开关后灵敏电流计指针未发生偏转 |
(1)配制FeCl3溶液时,先将FeCl3溶于浓盐酸,再稀释至指定浓度。结合化学用语说明浓盐酸的作用:。
(2)甲同学探究实验I的电极产物______________。
①取少量Na2SO3溶液电极附近的混合液,加入______________,产生白色沉淀,证明产生了 。
。
②该同学又设计实验探究另一电极的产物,其实验方案为______________。
(3)实验I中负极的电极反应式为______________。
(乙同学的实验)
乙同学进一步探究FeCl3溶液与NaHSO3溶液能否发生反应,设计、完成实验并记录如下:
| 装置 | 编号 | 反应时间 | 实验现象 |
| 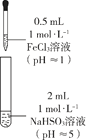
| III | 0~1 min | 产生红色沉淀,有刺激性气味气体逸出 |
| 1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 |
| 30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
(4)乙同学认为刺激性气味气体的产生原因有两种可能,用离子方程式表示②的可能原因。
① Fe3++3
 Fe(OH)3 +3SO2;②______________。
Fe(OH)3 +3SO2;②______________。
(5)查阅资料:溶液中Fe3+、 、OH-三种微粒会形成红色配合物并存在如下转化:
、OH-三种微粒会形成红色配合物并存在如下转化:
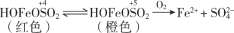
从反应速率和化学平衡两个角度解释1~30 min的实验现象:______________。
(6)解释30 min后上层溶液又变为浅红色的可能原因:______________。
(实验反思)
(7)分别对比I和II、II和III,FeCl3能否与Na2SO3或NaHSO3发生氧化还原反应和有关(写出两条)______________。
-
电化学手段对于研究物质性质以及工业生产中都有重要价值。
I. 某实验小组利用原电池装置对 FeCl3与Na2SO3的反应进行探究。
| 装置 | 实验现象 |
| 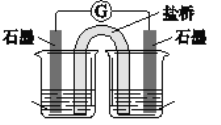
1 mol/L FeCl3溶液(pH≈1) 1mol/LNa2SO3 溶液(pH≈9) | 灵敏电流计指针发生偏转 |
(1)取少量 FeCl3溶液电极附近的混合液,加入铁氰化钾溶液,产生蓝色沉淀,证明 FeCl3转化成_____。
(2)检验另一电极产物的操作及现象是_____。
(3)负极的电极反应式为_____。
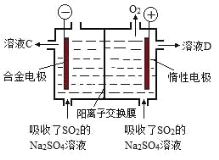
II. 工业上用 Na2SO4 溶液吸收工业烟气中的低浓度 SO2 形成吸收液后,再采用阳离子膜电解法, 控制电压,电解吸收液可制成产品 S 和 O2。工作原理示意图如下图
阴极区和阳极区的pH 随时间的变化关系如下图:
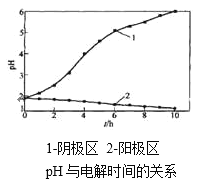
(4)阳极反应的电极反应物是 ____。
(5)阳极区 pH 降低的原因是____。(写出一条即可)
(6) 结合电极反应式,说明阴极区 pH 升高的原因_____。(写出一条即可)
-
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:
(已知:MnO4-在酸性环境下的还原产物是Mn2+ )
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体(H2C2O4·2H2O) g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和 .
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L KMnO4溶液和几滴稀硫酸.现象如下表所示:
| 试管1 | 试管2 |
| 实验现象 | 褪色很快 | 褪色很慢 |
| 褪色时间/s | 4秒 | 31秒 |
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是: .
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为: .
③同学测出的颜色变化的时间是以下列哪个选项为依据的 .
A、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫 红色为止.
B、从KMnO4溶液刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是 .
于是甲同学得出结论 .
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率 因素的另外两种可能原因,你认为他们提出的两种可能原因是:
I II
-
某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
①针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
Ⅰ.根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ.仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
Ⅲ.向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
②进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整: Cu2++ SCN -= CuSCN↓+ (SCN)2__
③结合上述过程以及Fe(SCN)3⇌Fe3++3SCN -的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
-
为探究Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知: (橙色)+ H2O⇌
(橙色)+ H2O⇌ (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
| 序号 | 操作 | 现象 |
| i | 配制饱和Na2SO3 溶液,测溶液的pH | pH 约为 9 |
| ii | 配制0.05 mol·L−1 的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得到pH=2 的溶液A 和 pH=8 的溶液B | pH=2的溶液A 呈橙色;pH=8的溶液 B 呈黄色 |
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验iii 和 iv:
| 序号 | 操作 | 现象 |
| iii | 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液变绿色(含Cr3+) |
| iv | 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液没有明显变化 |
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验v:
| 序号 | 操作 | 现象 |
| v | 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液A | 溶液变黄色 |
| vi | 向 2 mL 蒸馏水中滴加 3 滴溶液A | 溶液变浅橙色 |
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
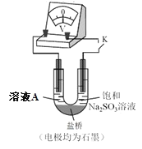
a.K 闭合时,电压为a。
b.向U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。
-
某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路(已知发生的反应为 2FeCl3 + Cu =2FeCl2 + CuCl2)。课外活动小组为确认生产后的废液的组成,进行如下实验:
(1)取100 mL废液加入足量的AgNO3溶液,生成沉淀 86.1g。
(2)另取100 mL废液放入铜片充分反应,铜片质量减少了2.56 g。
下列关于原废液组成的判断错误的是
A.c(Fe2+)︰c(Fe3+)︰c(Cu2+) = 2︰1 ︰1
B.c(Fe2+)︰c(Cu2+) = 2︰1
C.一定含有Fe 2+、Fe 3+、Cu2+、Clˉ
D.c(Clˉ) =" 6mol" / L,c(Fe 2+) =" 1.2mol" / L
-
(12分)某研究性课题小组对氢氧化钠溶液和稀盐酸中和反应的有关问题,进行了如下探究:
Ⅰ:(1)甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如下图所示实验。

则X溶液是▲ 。
(2)乙同学也设计完成了另一个实验,证明氢氧化钠溶液与盐酸能够发生反应。在盛有25.00mL稀盐酸的锥形瓶中,用胶头滴管慢慢滴入氢氧化钠溶液,不断振荡,每加一滴溶液测定并记录一次溶液的pH值,直至氢氧化钠溶液过量。

①写出测定溶液pH值的操作方法:▲ ;
②上图中哪个图像符合该同学的记录▲ (填序号)。
(3)你认为甲、乙两位同学的实验中,▲ (填“甲同学”、“乙同学”、“甲乙两同学”)的实验能充分证明氢氧化钠溶液与盐酸发生了反应,请说明理由:▲ 。
Ⅱ:丙学生用0.100 mol·L-1氢氧化钠溶液滴定未知浓度的盐酸。他用移液管准确移取25.00mL未知浓度的盐酸置于一洁净的锥形瓶中,然后用0.100 mol·L-1的氢氧化钠溶液(指示剂为酚酞)进行滴定。滴定结果如下:
| 滴定次数 | 盐酸的体积/mL | NaOH溶液的体积/mL |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 1 | 25.00 | 2.00 | 20.20 |
| 2 | 25.00 | 1.02 | 21.03 |
| 3 | 25.00 | 0.20 | 20.20 |
(1) 根据以上数据计算出盐酸的物质的量浓度为▲ mol·L-1。
(2) 如果滴定的终点没有控制好,即NaOH溶液过量,溶液显深红色,如何补救?请设计实验方案。▲ 。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-的存在。