-
现有CuO和Fe2O3组成的混合物a g,向其中加入4.0mol•L-1硫酸溶液25mL时恰好完全反应.若将a g原混合物在足量CO中加热,使其充分反应,冷却后剩余固体质量为( )
A.1.6g
B.1.6ag
C.(a-0.8)g
D.(a-1.6)g难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.明矾、小苏打、醋酸、次氯酸均为电解质
B.碘酒、牛奶、豆浆、漂白精均为胶体
C.根据是否具有丁达尔现象可将分散系分为溶液、胶体和浊液
D.物质可根据在水中或熔化状态下的导电性分为电解质与非电解质难度: 中等查看答案及解析
-
下列各组物质的溶液,分别只用一种试剂一次就可加以区别的是( )
A.Na2SO4、BaC12、K2CO3、KNO3
B.NaAlO2、NaC1、Na2CO3、AgNO3
C.NaOH、KC1、K2CO3、MgCl2
D.HC1、NaNO3、Na2CO3、(NH4)2SO4难度: 中等查看答案及解析
-
对于下列各组中的两种物质,取等物质的量分别在足量氧气中燃烧,耗氧量相同的是( )
A.乙醇和乙酸
B.葡萄糖和环己烷
C.丙烷和乙酸乙酯
D.乙醛和乙醇难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g)═2NH3(g)△H<0.下列分析正确的是( )
A.平衡后加入N2,该反应的△H增大,平衡常数不变
B.若平衡后升高温度,NH3的体积分数增大,反应的平衡常数也增大
C.若反应前充入等物质的量的N2与H2,则在反应过程中,N2的体积分数始终为50%
D.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2高难度: 中等查看答案及解析
-
将2.24LCO2,(标准状况)通入150mLlmol•L-1NaOH溶液中(溶液体积变化忽略不计),充分反应后,下列对反应后溶液的说法正确的是( )
A.n(CO32-)+n(HCO3-)=0.1mol
B.c(CO32-)略小于c(HCO3-)
C.c(Na+)=0.15mol•L-1
D.反应后只有一种产物难度: 中等查看答案及解析
-
如图所示,将Zn棒和Cu棒插入1L 2mol•L-1稀H2SO4中下列说法正确的是( )
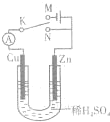
A.若电键K与N连接,由于发生原电池反应,Zn棒被保护不会腐蚀
B.若电键K与N连接,Zn棒上发生的反应是2H+-2e-=H2↑
C.若电键K与M连接,将稀H2SO4换成CuSO4溶液,可实现Zn棒上镀铜
D.若电键K与M连接,Cu棒上发生还原反应难度: 中等查看答案及解析