-
下列事实不能用勒夏特列原理解释的是( )
A. 氨水应密闭保存,放置于低温处
B. 在硫酸亚铁溶液中,加入铁粉以防止氧化变质
C. 生产硝酸的过程中使用过量空气以提高氨气的利用率
D. 实验室常用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
下列做法与可持续发展理念不符合的是
A. 加大清洁能源的开发利用,提高资源的利用率
B. 催化处理汽车尾气,减轻氮氧化物污染和光化学烟雾
C. 对工业废水、生活污水净化处理,减少污染物的排放
D. 加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
难度: 简单查看答案及解析
-
在水溶液中下列电离方程式书写正确的是( )
A. Ca(OH)2
Ca2++2OH- B. NaHCO3 = Na++H++CO32-
C. H2CO3
2H++CO32- D. Na2SO4 = 2Na++SO42-
难度: 简单查看答案及解析
-
已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ·mol﹣1
B. C2H2(g)+
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ·mol﹣1
C. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ·mol﹣1
D. 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ·mol﹣1
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是( )
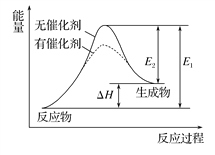
A. 该反应为放热反应
B. 催化剂能改变该反应的焓变
C. 催化剂能降低该反应的活化能
D. 逆反应的活化能大于正反应的活化能
难度: 简单查看答案及解析
-
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
铜锌原电池工作时,下列叙述不正确的是

A. 负极反应为Zn-2e-===Zn2+
B. 电池反应为Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从铜电极流向锌电极
D. 盐桥中的K+移向CuSO4溶液
难度: 简单查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2v正(NH3)=3v正(H2O)
难度: 中等查看答案及解析
-
已知25 ℃时水的离子积为Kw=1.0×10-14 ,35 ℃时水的离子积为Kw=2.1×10-14。下列说法中正确的是
A. 水中的c(H+)随温度的升高而降低
B. 25 ℃时水呈中性,35 ℃时水呈酸性
C. 水的电离过程是吸热过程
D. 一定温度下,向水中加入酸或碱时,水的离子积将发生变化
难度: 中等查看答案及解析
-
下列说法正确的是
A. 同温同压下,H2(g)+ Cl2(g)=2HCl(g)在光照和点燃条件的△H相同
B. 500 ℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g), 放热 akJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H= -2a kJ•mol-1
C. 甲烷的标准燃烧热(△H)为-890.3 kJ • mol -1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g) =CO2(g) +2H2O(g) △H=-890.3kJ•mol-1
D. HC1和NaOH反应的中和热△H= -57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol
难度: 中等查看答案及解析
-
在相同温度下,100 mL 0.01 mol·L-1醋酸溶液与10 mL 0.1 mol·L-1醋酸溶液相比,下列数值前者大于后者的是
A. 中和时所需NaOH的量 B. CH3COOH的电离程度
C. H+的物质的量浓度 D. CH3COOH的物质的量
难度: 中等查看答案及解析
-
在相同温度下(T=500 K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1 g SO2和1 g O2,乙容器中充入2 g SO2和2 g O2。下列叙述中错误的是
A. 化学反应速率:乙>甲 B. 平衡时O2的浓度:乙>甲
C. 平衡时SO2的转化率:乙>甲 D. 平衡时SO2的体积分数:乙>甲
难度: 中等查看答案及解析