-
氨在国民生产中占有重要的地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
(1)反应进行到2小时时放出的热量为____________kJ。
(2)此条件下该反应的化学平衡常数K=____________(保留两位小数)。
(3)有两个密闭容器A和B,A容器保持恒容,B容器保持恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g) 3H2(g)+N2(g)。则:
3H2(g)+N2(g)。则:
①达到平衡所需的时间:t(A)_____t(B),平衡时,NH3的转化率:a(A)______a(B) (填“>”、“=”或“<”)。
②达到平衡后,在两容器中分别通入等量的氦气。A中平衡向_________移动,B中平衡向_________移动。(填“向正反应方向”、“向逆反应方向”、“不”)。
(4)在三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数[φ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是_____(填字母,下同)。
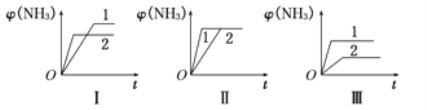
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
-
.(21分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度, V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡影响规律知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3)
d.混合气体中 c(NH3)不变
e.容器内混合气体的平均摩尔质量保持不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
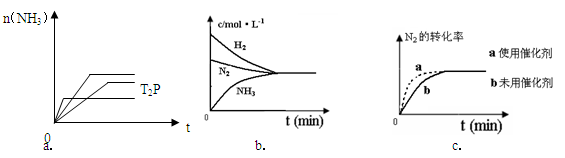
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
-
[s1] 合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
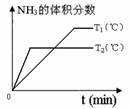
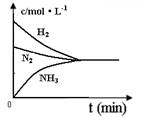
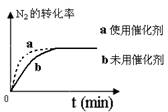
a. b. c.
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:
a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
[s1]24.
-
(12分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
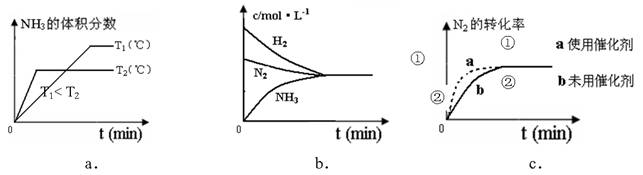
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;
B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
2NH3(g) △H= -92.4KJ/mol ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是_________________(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
-
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)______.
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=______.
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越______
(3)某温度下,若把10mol N2与30mol H2 置于体积为10L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=______(可用分数表示).能说明该反应达到化学平衡状态的是______(填字母).
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)______.
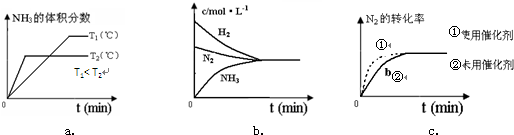
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3molH2,此时两容器的体积相等.在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ.则:
a______b(填>、=、<),Q1______ Q2(填>、=、<),Q1______92.4(填>、=、<).
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
2NH3(g)△H=-92.4KJ/mol,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)___________。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越__________。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
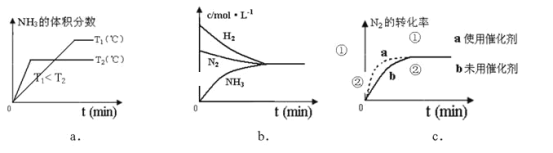
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②利于提高合成氨平衡产率的条件有________。
A、低压 B、高压 C、催化剂 D、增加氮气的充入量 E、及时移走氨气
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_______b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=______________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
-
合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越______。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=_________(可用分数表示)。能说明该反应达到化学平衡状态的是_______(填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.v正(N2)=2v逆(NH3) d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是_________(选填序号)。
a.  b.
b. 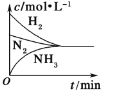 c.
c. 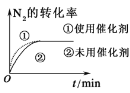
(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a______b(填“>”“=”或“<”,下同),Q1_____92.4。
2NH3(g) △H=-92.4kJ/mol。下表是合成氨反应在某温度下2.0L的密闭容器中进行时,测得的数据:
3H2(g)+N2(g)。则:










 b.
b.  c.
c. 