-
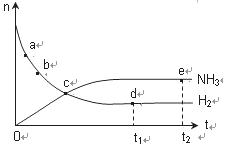
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g)  2NH3(g),在673 K、30 Mpa下,n(NH3)和n(H2)随时间变化的关系如右图所示,下列叙述正确的是( )
2NH3(g),在673 K、30 Mpa下,n(NH3)和n(H2)随时间变化的关系如右图所示,下列叙述正确的是( )
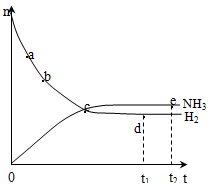
A.点a处反应速率比点b的大
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.点a处v(H2)正 =v(H2)逆
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的放热反应:N2(g)+ 3H2(g) 2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
2NH3(g),673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。
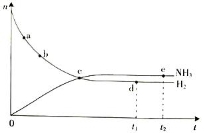
下列叙述正确的是
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g)  2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
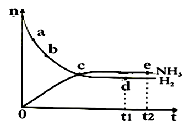
A.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
B.点c处反应达到平衡
C.点a的正反应速率比点b的大
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g) + 3H2(g)  2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
2NH3(g),△H<0,在673 K,30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示,叙述正确的是( )
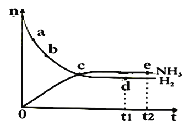
A.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
B.点c处反应达到平衡
C.点a的正反应速率比点b的大
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值小
-
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭 容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g)(正反应为放热反应),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
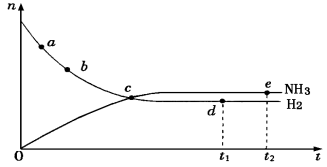
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d (t1时刻)和点e (t2时刻)处n (N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的放热反应:N2(g)+3H2(g)=2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是:
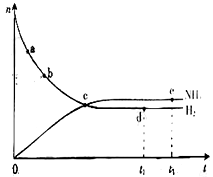
A.点a的正反应速率比点b的大
B. 点c处反应达到平衡
C. 点d (t1时刻)和点e (t2时刻)处n(N2)相等
D.其他条件不变,升温到773K下,反应至t1时刻, n(H2)比上图中的d点值要大
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
N2(g)+3H2(g)  2NH3(g) △H <O,673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g) △H <O,673 K,30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
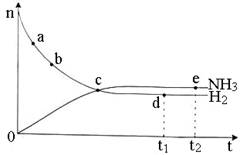
A.点b的正反应速率比点a的大 B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
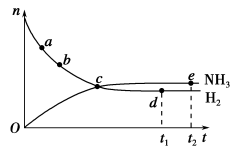
A.点a的正反应速率比点b的小
B.点c处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)  2NH3(g) △H <0,在673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )
2NH3(g) △H <0,在673K、30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )
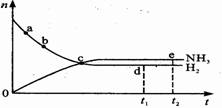
A、点 c处反应达到平衡
B、点a的正反应速率比点b的大
C、点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D、其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值小。
【解析】c点之后物质的量是变化的,所以c点没有达到平衡状态,A不正确。A点反应物的浓度减小,生成物的浓度增加,所以a点正反应速率大于逆反应速率,B正确。d和e均是相同条件下的平衡状态,所以氮气的物质的量是相同的,C不正确。因为反应是放热反应,所以温度升高,平衡向逆反应方向移动,氢气的物质的量是增加的,因此D也是错误的。答案选B。
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
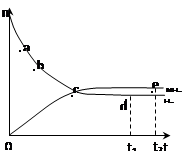 N2(g)+3H2(g)
N2(g)+3H2(g)  2NH3(g) 673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
2NH3(g) 673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大









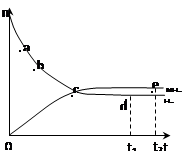 N2(g)+3H2(g)
N2(g)+3H2(g) 