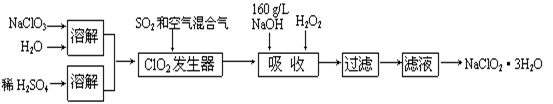
-
实验室里需用480ml 0.1mol·L-1的硫酸铜溶液,现配制该浓度的溶液,以下操作正确
A.称取7.68g硫酸铜,加入500mL水 B.称取12.0g胆矾配成500mL溶液
C.称取8.0g硫酸铜,加入500mL水 D.称取12.5g胆矾配成500mL溶液
难度: 中等查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol-1 ,下列说法中正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属
B.l mol C22H46中含有的C—C键个数约为21×6.02×1023
C.0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023
D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023
难度: 中等查看答案及解析
-
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响同时产生白色烟雾。撞击时发生的化学方程式为:5KC1O3+6P === 3P2O5+5KC1,下列有关叙述正确的是
A.上述反应中氧化剂和还原剂的物质的量之比为6:5
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.上述反应中消耗2molP时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述正确的是
A.13.6g熔融的KHSO4中含有0.2NA个阳离子
B反应Cu2S+O2
2Cu+SO2(Cu2S中的Cu元素为+1价)生成1molCu,电子转移数为3NA
C.常温常压下,4.6gNO2气体中含有的分子数为0.1 NA
D.31 g P4(正四面体结构)所含共价键数为4NA
难度: 中等查看答案及解析
-
下列实验方法合理的是
A.可用水鉴别己烷、四氯化碳、乙醇三种无色溶液
B.油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C.可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D.为准确测定盐酸和NaOH溶液反应的中和热,所用酸和碱的物质的量应相等
难度: 中等查看答案及解析
-
用向上排空气法在容积为V mL的集气瓶中收集HCl,收集后瓶内气体的密度是相同条件下He密度的8.5倍.将此集气瓶倒置于水中,瓶内水面上升到一定高度后立即停止上升,则同温同压下,瓶内剩余气体的体积为
A. V/4 mL B.V/3 mL C.V/5 mL D.无法判断
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数。下列叙述正确的是
A.物质的量相等的Na2O和Na2O2晶体,所含有离子个数相同
B.在含有NA个CH3COO-的醋酸溶液中, H+ 数目等于NA
C.1molCH3+(碳正离子)中含电子数目为9NA
D.1mol丙烯酸含有的双键数目为NA
难度: 中等查看答案及解析
-
将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是
A、若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B、产物的平均摩尔质量为24g/mol
C、若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为原来的1/3
D、反应中消耗的氧气为56g
难度: 中等查看答案及解析
-
将Na2CO3·1OH2O和NaHCO3的混合物ng溶于水制成200ml溶液,C(Na+)=0.5mol/L,若将混合物ng加热至质量不再改变时,减少质量可能为
A.3.1g B.5.3g C.9.0g D.11.0g
难度: 中等查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.小苏打溶液中加入少量NaCl固体
C.氨水中加入少量NH4Cl固体 D.Na2CO3溶液加热
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.醋酸的电离程度增大,C(H+)亦增大
B.再加入10ml pH=11的NaOH溶液,混合液pH=7
C.溶液中导电粒子的数目减少
D.溶液中
不变
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是
A.饱和氯水中
、
、
、
B.
溶液中
、
、
、
C.pH=13的溶液中
、
、
、
D.由水电离
溶液中
、
、
、
难度: 中等查看答案及解析
-
下列实验方案中,不能测定Na2CO3和和NaHCO3混合物中Na2CO3质量分数的是
A.取a克混合物与稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
B.取a克混合物与稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物充分加热,减重b克
D.取a克混合物与Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
难度: 中等查看答案及解析
-
下列关于氨气的说法正确的是
A.氨气可以用碱石灰干燥也可用无水CaCl2干燥
B.氨水能导电,所以NH3是电解质
C.沸点:NH3<PH3<AsH3
D.用水吸收NH3用下图装置可防止倒吸:
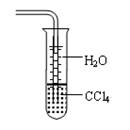
难度: 中等查看答案及解析
-
将F2通入到热的NaOH溶液中可发生氧化还原反应,其中F2和NaOH等物质量进行反应,生成物中有NaF、H2O和另一种气体,则该气体可能是
A.H2 B.HF C.OF2 D.O2
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.将SO2气体通入NaClO溶液中:SO2+2ClO-+H2O====SO32—+2HClO
B.FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
C.在硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7
2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
D.NH4HCO3溶液与少量NaOH溶液反应:NH++OH-=NH3·H2O
难度: 中等查看答案及解析
-
现有①NaOH ②Al2(SO4)3 ③Ba(NO3)2 ④CuSO4 ⑤FeCl3 ⑥淀粉溶液 ⑦KI 这7种溶液
A.不需外加试剂即可鉴别 B.必须外加试剂才能鉴别
C.如有碘水即能全部鉴别 D.另有一种溶液即可鉴别
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。根据上述实验事实推断,在该溶液中肯定存在的离子组是
A.Na+、Br-、CO32- B.Na+、 I-、SO32-
C.Fe2+、I-、SO32- D.Fe2+、Br-、CO32-
难度: 中等查看答案及解析
-
已知OCN-中每种元素都满足8电子稳定结构,在反应OCN-+OH-+C12→CO2+N2+C1-+H2O(未配平)中,如果有6 mol C12完全反应,则被氧化的OCN-的物质的量是
A.2 mol B.3 mol C.4 mol D.6 mol
难度: 中等查看答案及解析
-
将铝粉与Fe3O4粉末配制成铝热剂,分成三等份。①一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为V1;②一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为V2;③一份直接放入足量的盐酸中,充分反应后放出气体在标准状况下的体积为V3.下列说法正确的是
A.V1=V3>V2 B.V2 >V1 =V3 C.V1= V2>V3 D.V1>V3>V2
难度: 中等查看答案及解析