-
判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定自发进行的是
A.ΔH>0,ΔS>0 B.ΔH<0,ΔS>0 C.ΔH>0,ΔS<0 D.ΔH<0,ΔS<0
难度: 简单查看答案及解析
-
水中加入下列溶液对水的电离平衡不产生影响的是
A.NaHSO4溶液 B.NaOH溶液 C.KAl(SO4)2溶液 D.KI溶液
难度: 简单查看答案及解析
-
我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是
A.反应物的多少 B.反应进行的方向
C.反应进行的限度 D.反应的快慢
难度: 简单查看答案及解析
-
升高温度,下列数据不一定增大的是
A.化学反应速率v B.水的离子积常数Kw
C.化学平衡常数K D.醋酸的电离平衡常数Ka
难度: 简单查看答案及解析
-
某实验报告记录了如下数据,其中数据合理的是
A.用广泛pH试纸测得氯水的pH为2.1
B.用50mL量筒量取23.00 mL浓盐酸
C.用温度计测量出酒精的沸点为78.5℃
D.用托盘天平称量氧化铜粉末为11.70g
难度: 简单查看答案及解析
-
在四个不同的容器中进行合成氨的反应。根据下列在相同时间内测定的结果,判断生成氨的速率最快的是
A.v (N2)=0.05mol·L-1·s-1 B.v (H2)=0.3mol·L-1·min-1
C.v (N2)="0.2" mol·L-1·min-1 D.v (NH3)="0.3" mol·L-1·min-1
难度: 简单查看答案及解析
-
下列化学用语的表述对应正确的是
A.碳酸氢钠的电离方程式:NaHCO3===Na++H++CO32-
B.用铜做阳极电解氯化铜溶液的离子方程式:Cu2++2Cl-
Cu+Cl2↑
C.硫化钠水解的离子方程式:S2-+2H2O
H2S+2OH-
D.碳酸钙的溶解平衡:CaCO3(s)
Ca2+(aq) + CO32-(aq)
难度: 简单查看答案及解析
-
反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是

A. B. C. D.
难度: 简单查看答案及解析
-
25℃时,在0.01mol/L的氢氧化钡溶液中,由水电离出的c(OH-)浓度是
A.0.02mol/L B.5×10-13mol/L C.1×10-7mol/L D.1×10-12mol/L
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中一定能大量共存的是
A.含有Fe3+的溶液: Na+、SCN-、Cl-、I-
B.含有大量NO3-的溶液: H+、Fe2+、Cl-、SO42-
C.常温下,pH=12的溶液: K+、Cl-、SO32-、AlO2-
D.c(H+)=0.1 mol·L-1的溶液: Na+、NH4+、SO42-、S2O32-
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g) + H2O(g)=CO2(g)+3H2(g) △H=+49.0 kJ·mol-1
②CH3OH(g)+ 1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1
根据上述反应,下列说法正确的是
A.反应①中的能量变化如右图所示

B.CH3OH转变成H2的过程一定要吸收能量
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.可推知2H2(g)+O2(g)=2H2O(g)△H =-483.8 kJ·mol-1
难度: 简单查看答案及解析
-
常温下a mol·L-1 CH3COOH稀溶液和bmol·L-1KOH稀溶液等体积混合,下列判断一定错误的是
A.若c(OH-)>c(H+),a=b B.若c(K+)<c(CH3COO-),a<b
C.若c(OH-)=c(H+),a>b D.若c(K+)>c(CH3COO-),a>b
难度: 简单查看答案及解析
-
高温下,某反应达平衡,平衡常数K =
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小 D.该反应化学方程式为CO+H2O
CO2+H2
难度: 简单查看答案及解析
-
下列说法与盐的水解无关的是
①纯碱溶液去油污
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂
④在NH4Cl溶液中加入金属镁会产生氢气
⑤草木灰与氨态氮肥不能混合施用
A.① ③ ④ B.② ③ ⑤ C.③ ④ ⑤ D.全有关
难度: 简单查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2 Ni(OH)2+2OH--2e-=Ni2O3+3H2O
难度: 简单查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:
3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是 ( )
A.该反应的化学平衡常数表达式是K=
B.此时B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
难度: 简单查看答案及解析
-
如右图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列法不正确的是

A.左侧气体颜色先变深后逐渐变浅
B.对于2NO2
N2O4平衡体系 ,向生成N2O4的方向移动
C.压缩后U型管内两侧液面仍然保持水平
D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平
难度: 简单查看答案及解析
-
右图为铅蓄电池的示意图。下列说法正确的是
A.放电时,N为负极,其电极反应式为: PbO2+SO42-+4H++2e-=PbSO4+2H2O
B.放电时,c(H2SO4)不变,两极的质量增加
C.充电时,阳极反应式为:PbSO4+2e-= Pb+SO42-
D.充电时,若N连电源正极,则该极生成PbO2
难度: 简单查看答案及解析
-
在室温下,下列叙述正确的是
A.将1 mL 1.0×10—5 mol/L盐酸稀释到1000 mL,得到pH=8 的盐酸
B.将1 mL pH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸
C.用pH=1盐酸分别中和1 mL pH=13 NaOH溶液和氨水,NaOH消耗盐酸的体积大
D.pH=2的盐酸与pH=1的硫酸比较,2 c(Cl— )=c(SO42— )
难度: 简单查看答案及解析
-
一定条件下,N2(g)和H2(g)反应生成2molNH3(g)放出92.4kJ热量。在相同条件下向密闭容器中通入1molN2和3molH2,达到平衡时放出热量为Q1kJ;向另一体积相同的密闭容器中通入0.5molN2、1.5molH2和1molNH3,相同条件下达到平衡时放出热量为Q2kJ。则下列关系式正确的是
A.2Q2=Q1=92.4 B.Q2<Q1<92.4
C.Ql<Q2<92.4 D.Ql=Q2<92.4
难度: 简单查看答案及解析
-
下图表示的是难溶氢氧化物在不同pH下的溶解度(S/mol·L-1),下列说法中正确的是

A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
难度: 简单查看答案及解析
-
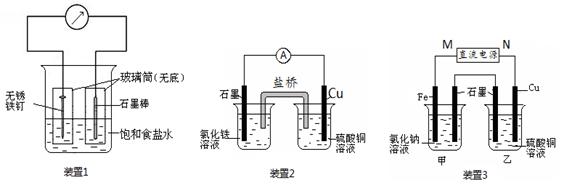
关于下列各装置图的叙述不正确的是


① ② ③ ④
A.用图①装置精炼铜,a极为粗铜,电解质溶液为CuSO4溶液
B.图②装置盐桥中KCl的Cl—移向乙烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
难度: 简单查看答案及解析
-
用Cl2生产某些含氯有机物时会产生副产物HC1。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量。
Ⅱ、

判断下列说法正确的是
A.反应A的△H >-115.6 kJ·mol-1
B.H2O中H—O 键比HCl中H—Cl键弱
C.由Ⅱ中的数据判断氯元素的非金属性比氧元素强
D.断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为32kJ
难度: 简单查看答案及解析
-
一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如下图所示。下列判断判断正确的是

A.在0?50min之间,pH=2和pH=7时R的降解百分率相等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20?25min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
难度: 简单查看答案及解析
-
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示。下列有关离子浓度关系叙述正确的是

A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点表示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)
C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1
D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):
c(H+)=c(CH3COOH)+c(OH-)
难度: 简单查看答案及解析