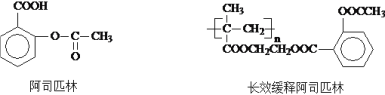
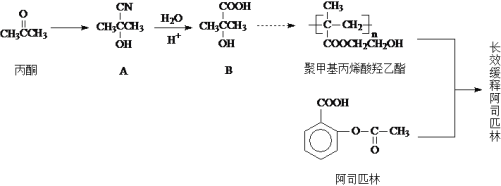
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A. 至少存在5种离子
B. Cl-一定存在,且c(Cl‑)≥0.4mol/L
C. SO42-、NH4+、一定存在,Cl-可能不存在
D. CO32-、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析
-
-NMR(核磁共振)、
-NMR可用于测定蛋白质、核酸等生物大分子的空间结构下面有关
、
的叙述正确的是( )
A.
与
有相同的质子数 B.
与C60互为同素异形体
C.
与
互为同位素 D.
的核外电子数与中子数相同
难度: 简单查看答案及解析
-
金属单质具有的通性是( )
A. 硬度大 B. 具有金属光泽、导电、导热和延展性
C. 熔沸点高 D. 质地柔软
难度: 简单查看答案及解析
-
下列有关化工生产不涉及化学变化的是( )
A. 合成氨 B. 煤干馏 C. 海带提碘 D. 石油分馏
难度: 简单查看答案及解析
-
在中和滴定中用于量取20.00毫升待测溶液的仪器是( )
A. 胶头滴管 B. 容量瓶 C. 滴定管 D. 量筒
难度: 简单查看答案及解析
-
下列物质中,常温下可以使用铁制的容器来储存的是( )
A. 稀硝酸 B. 浓硝酸 C. 浓盐酸 D. 稀盐酸
难度: 简单查看答案及解析
-
下列关于NH3的描述错误的是( )
A. 含有极性共价键 B. 空间构型是三角锥型
C. 极易溶于水 D. 能用湿润的蓝色石蕊试纸检验
难度: 中等查看答案及解析
-
化学键是一种相互作用,它存在于( )
A. 分子之间 B. 物质中的原子之间
C. 构成物质的所有微粒之间 D. 分子或原子团中相邻的原子之间
难度: 简单查看答案及解析
-
下列有机物的命名,错误的是( )
A. 2-乙基丁烷 B. 2,2—二甲基丙烷
C. 2,3—二甲基丁烷 D. 2—甲基丙烷
难度: 简单查看答案及解析
-
浓硫酸具有很多重要的性质,在于含有水分的蔗糖作用过程中不能显示的性质是
A. 酸性 B. 吸水性 C. 脱水性 D. 强氧化性
难度: 简单查看答案及解析
-
把溴从溴水中提取出来,采用的最好方法是( )
A. 蒸发 B. 用酒精萃取 C. 用四氯化碳萃取 D. 通入氯气
难度: 简单查看答案及解析
-
以下各种尾气吸收装置中,不适合于吸收氨气的是( )
A.
 B.
B. 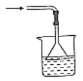 C.
C. 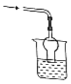 D.
D. 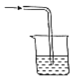
难度: 简单查看答案及解析
-
自来水可用氯气消毒,某学生用这种自来水配制下列物质的溶液,不会产生明显药品变质问题的是( )
A. AlCl3 B. FeCl2 C. AgNO3 D. Na2CO3
难度: 简单查看答案及解析
-
已知铊与铝是同主族元素,关于铊的性质推断可能错误的是( )
A. 铊是银白色、质软的金属 B. 铊不能形成气态氢化物
C. 铊与稀硝酸反应生成Tl(NO3)3 D. Tl(OH)3是两性氢氧化物
难度: 简单查看答案及解析
-
苯是实验室常用的萃取剂,下列关于苯的说法错误的是( )
A. 常温下是液体 B. 密度比水小
C. 能和液溴发生加成反应 D. 能和硝酸发生取代反应
难度: 简单查看答案及解析
-
对S、Cl两种元素,以下说法错误的是( )
A. 非金属性:S < Cl B. 离子半径:S2- < Cl-
C. 气态氢化物稳定性:H2S < HCl D. 单质氧化性:S < Cl2
难度: 简单查看答案及解析
-
设
为阿伏加德罗常数的值。下列说法正确的是( )
A. 14g由N2与CO组成的混合气体含有的原子数目为
B. 78g苯含有碳碳双键的数目为3
C. 1L 1mol
的NaClO溶液中含有ClO-的数目为
D. 6.72L NO2与水充分反应转移的电子数目为0.2
难度: 中等查看答案及解析
-
实验室制乙炔的实验中,下列说法错误的是( )
A. 反应的原料之一CaC2,俗称电石,是由焦炭、熟石灰在电炉中高温反应制得
B. 在实验中可用饱和食盐水代替纯水,有利于控制反应速率
C. 该反应原理是:CaC2+2H2O→HC
CH
+Ca(OH)2
D. 反应过程中会闻到难闻的气味是因为电石中含有的杂质造成的
难度: 简单查看答案及解析
-
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
A. 脱氧过程中铁作为原电池正极
B. 负极的电极反应为:Fe-3e→Fe3+
C. 正极的电极反应为:2H2O+O2+4e→4OH-
D. 脱氧过程是吸热反应,可降低温度,延长糕点保质期
难度: 简单查看答案及解析
-
以下测定胆矾结晶水含量的操作中,正确的是( )
A. 加热、冷却、称量,重复两次即是恒重操作
B. 瓷坩埚加热后冷却时,必须放在干燥器中
C. 加热晶体时先用小火,后渐改为用大火加热
D. 加热时如果有晶体溅出坩埚,应再加一些晶体
难度: 简单查看答案及解析