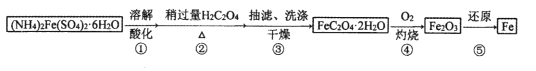
-
一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍(已知常温下
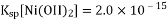 ),工艺流程如下。下列叙述错误的是
),工艺流程如下。下列叙述错误的是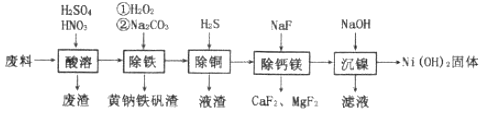
A. 废渣的主要成分为二氧化硅
B. 黄钠铁矾渣中铁元素为+3价
C. 除钙镁过程中,为了提高钙镁的去除率,氟化钠实际用量应该越多越好
D. “沉镍”过程中为了将镍沉淀完全,需调节溶液pH>9
难度: 中等查看答案及解析
-
化学推动着社会的进步和人类的发展。下列说法错误的是
A. “长飞光纤光缆技术创新工程”中光纤的主要成分是二氧化硅
B. “半纤维素酶高效生产及应用关键技术”中半纤维素酶的主要成分是蛋白质
C. “废旧聚酯高效再生及纤维制备产业化集成技术”中聚酯是天然高分子有机物
D. “煤制烯烃大型现代煤化工成套技术开发及应用”中煤的气化属于化学变化
难度: 简单查看答案及解析
-
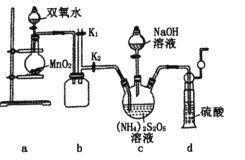
某学习小组设计用98%的浓硫酸制取
并验证其部分性质的实验装置图如下(夹持装置省略)。下列叙述不正确的是
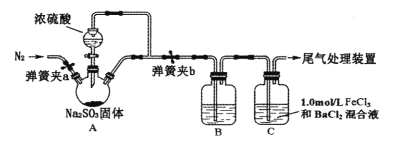
A. 装置A中发生的离子反应方程式为:
B. 若装置B中装有品红溶液,观察到B中溶液红色褪去,则说明
具有漂白性
C. 若装置B中装有酸性高锰酸钾溶液,观察到B中溶液褪色,则说明
具有还原性
D. 装置C产生的白色沉淀为BaSO4
难度: 中等查看答案及解析
-
设
为阿伏加德罗常数的值。下列说法错误的是
A. 0.1mol
和0.1mol
于密闭容器中充分反应,反应后分子总数为0.2
B. 向过氧化钠中通入足量的二氧化碳,当固体增重28g,转移电子数为l
C. 在标准状况下,22.4LHF与
个
中含有的电子数相同
D. 含有
个
胶粒的氢氧化铁胶体中,铁元素的质量大于56g
难度: 中等查看答案及解析
-
碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
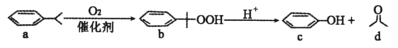
A. a的同分异构体有7种 B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为
D. b、c互为同系物
难度: 中等查看答案及解析
-
元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17。下列说法正确的是
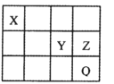
A. 简单离子半径(r):r(Q)>r(Y)>r(Z)
B. 氧化物对应的水化物的酸性:Z>Y
C. XY2和XZ4均含有非极性共价键
D. 标准状况下Z的单质状态与Q的相同
难度: 中等查看答案及解析
-
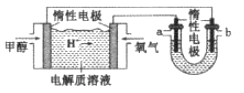
LED系列产品是一类新型节能产品。图甲是
/
燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是
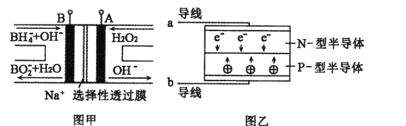
A. 电池总反应为:
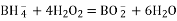
B. 电池放电过程中,
从B极区向A极区移动
C. 电池放电过程中,B极区pH减小,A极区pH增大
D. 要使LED发光二极管正常发光,图乙中的导线a应与图甲中的A极相连
难度: 中等查看答案及解析
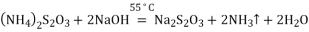
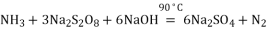

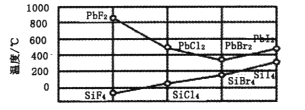
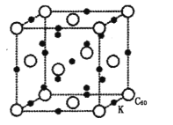
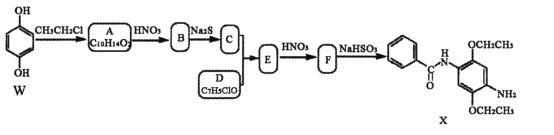
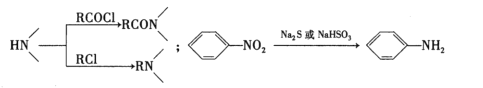
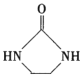 )的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
)的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。