-
(16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)CO2的电子式为: 。
(2)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(3)甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
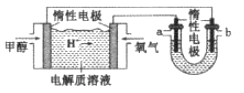
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的燃料电池装置。
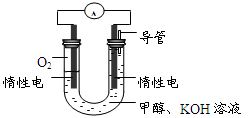
①该电池负极的电极反应为: 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
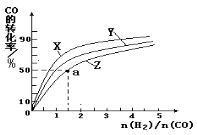
(5)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+ 2H2(g)  CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
-
(15分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)已知:① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式 。
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下左图:
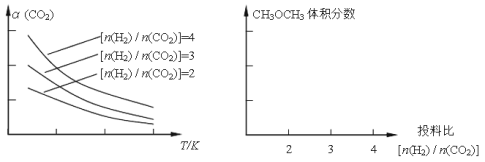
①在其他条件不变时,请在上图中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图。
②某温度下,将2.0 mol CO2(g)和6.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如下图所示,关于温度和压强的关系判断正确的是 。
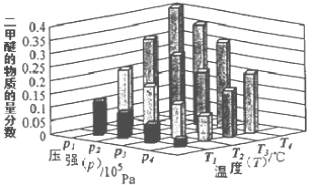
A. P3>P2,T3>T2 B. P1>P3,T1>T3
C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的平衡常数的表达式为:
该反应的正反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下CO的平衡转化率为 。
-
(13分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+________H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+________
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v (CO2) 表示的反应速率为________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 ________(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:
。
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
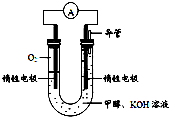
①该电池负极的电极反应为:________。
②该电池工作时,溶液中的OH-向______极移动。
-
(16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4 =□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| | | | | | |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K= ,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1 =-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g) ΔH2 =-566.0 kJ/mol
③H2O(g)=H2O(l) ΔH3 =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
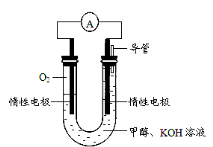
该电池正极的电极反应式为 ;该电池工作时,溶液中的OH-向 (填“正”或“负”)极移动。
-
(14分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v (CO2) 表示的反应速率为________(取小数点后二位,下同)。
②该反应为 ________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
(3) 某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
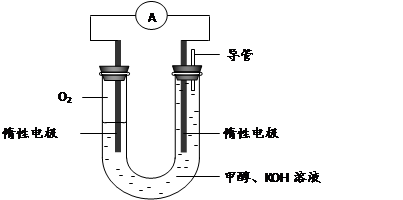
①该电池正极的电极反应为________。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 ________。
⑷CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为________。
-
(10分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+6 H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ 6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v (CO2) 表示的反应速率为________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 ________(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
________
⑷某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
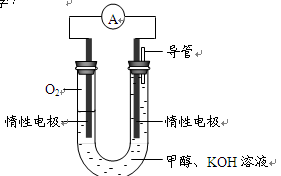
① 该电池正极的电极反应为
。
②该电池工作时,溶液中的OH-向______极移动。
-
(16分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4→____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v (CO2) 表示的反应速率为________ (取小数二位,下同)。
②该反应为 ________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
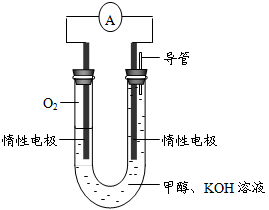
①该电池正极的电极反应为________。
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 ________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为________。
-
(10分)“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+6 H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ 6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以v (CO2) 表示的反应速率为________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 ________(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
________
⑷某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
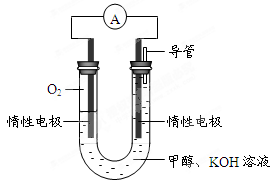
①该电池正极的电极反应为________。
②该电池工作时,溶液中的OH-向______极移动。
-
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
___ C+ ___ KMnO4+ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1中以CO2表示的化学反应速率为__________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=_________,该反应为 _____(填“吸”或“放”)热反应。
(3)已知在常温常压下:
① 2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:_____________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
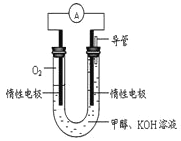
①该电池负极的电极反应为:_______________。
②该电池工作时,溶液中的OH-向______极移动。
-
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4 =□CO2↑+□MnSO4 +□K2SO4+□________
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的平均反应速率为________(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=____ _____,该反应为 ________(填“吸热”或“放热”)反应。
(3)已知在常温常压下:
① 2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1 =-1275.6 kJ/mol
② 2CO (g)+ O2(g)=2CO2(g) ΔH2 =-566.0 kJ/mol
③ H2O(g)=H2O(l) ΔH3 =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:________。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
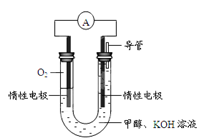
①该电池正极的电极反应式为:________;
②该电池工作时,溶液中的OH-向______(填“正”或“负”)极移动。
的含量及有效地开发利用
,引起了全世界的普遍重视。将
转化为甲醇:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),此研究对
的深度开发应用和构建生态文明社会具有重要的意义。
和3 mol
进行上述反应。测得
(g)和
(g)浓度随时间变化如图所示。

(g)和2mol
(g),则平衡______________(填“正向”“逆向”或“不”)移动。
的体积分数不变 c.c(
)=3c(
)
CH3OH(g)+H2O(g)
(l)燃烧热的热化学方程式为_______________________________。
气体,使所得溶液c(
):c(
)=2:1,则此时溶液中的c(
)= ________________
。(室温下,H2CO3的
;
)。











