-
NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 将含1molFeCl3的溶液滴入沸水中,所制得的Fe(OH)3胶体粒子为NA
B. 常温常压下,1 mol甲基(-CH3)所含电子数为10NA
C. 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D. 标准状况下,11.2L三氯甲烷中含有的极性共价键数目为1.5NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为( )
A. 将大理石溶于醋酸中:2CH3COOH+CaCO3===2CH3COO-+Ca2++CO2↑+H2O
B. 氯化铝溶液中加入过量的氨水:Al3+ + 4NH3·H2O = AlO2-+ 4 NH4++2H2O
C. NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O
D. 向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 自发反应的熵一定增大,非自发反应的熵一定减小
B. 吸热的熵增加反应一定能自发进行
C. 反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
D. 常温下,反应C(s)+CO2(g)
2CO(g)不能自发进行,则该反应的ΔH>0
难度: 中等查看答案及解析
-
某反应过程中能量变化如图所示,下列有关叙述正确的是( )
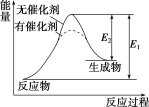
A. 该反应为放热反应
B. 催化剂能够增大反应体系中活化分子的百分数,升高温度和增大压强也能
C. 催化剂改变了化学反应过程,所以改变了化学反应的热效应
D. 催化剂降低了反应的活化能,从而改变了化学反应速率
难度: 中等查看答案及解析
-
下列推论正确的是 ( )
A. 2C(s)+O2(g)===2CO(g) ΔH=-221kJ·mol-1,则碳的燃烧热大于110.5kJ·mol-1
B. C(石墨,s)===C(金刚石,s) ΔH=+1.9kJ·mol-1,则金刚石比石墨稳定
C. OH-(aq)+H+(aq)= H2O(l) ΔH=-57.4kJ·mol-1,则:含20gNaOH的稀溶液与过量稀醋酸完全反应,放出的热量为28.7kJ
D. S(g)+O2(g)===SO2(g) ΔH1;S(s)+O2===SO2(g) ΔH2,则ΔH1>ΔH2
难度: 中等查看答案及解析
-
对于反应A2(g)+3B2(g)=2AB3(g)来说,下列所表示的化学反应速率最快的是()
A. v(A2)=0.01mol/(L·s) B. v(B2)=1.0mol/(L·min)
C. v(AB3)=0.9mol/(L·min) D. v(A2)=0.4mol/(L·min)
难度: 中等查看答案及解析
-
分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
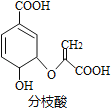
A. 可与乙醇、乙酸反应,且反应类型相同
B. 分子中含有3种官能团
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
已知下列操作和现象,所得结论正确的是
选项
操作和现象
结论
A
其他条件不变,缩小H2(g)+I2 (g)
2HI(g)的平衡体系的容器容积,气体颜色变深
增大压强,平衡逆向移动
B
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜
蔗糖未水解
C
向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀
蛋白质均发生了变性
D
其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短
当其他条件不变时,升高反应温度,化学反应速率加快
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
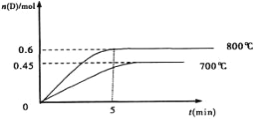
密闭容器中进行的可逆反应:aA(g)+bB(g)
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
难度: 困难查看答案及解析
-
一定温度下,反应①C(s)+CO2(g)===2CO(g) ΔH>0,反应②2SO2(g)+O2(g)===2SO3(g) ΔH<0。下列有关以上两个反应的说法正确的是
A. 降低温度反应①的速度减小,反应②的速率增大
B. 增大压强反应①的速率不变,反应②的速率增大
C. 增大压强反应①的速率增大,反应②的速率增大
D. 升高温度反应①的速率增大,反应②的速率减小
难度: 简单查看答案及解析
-
450℃时,在某恒容密闭容器中存在反应:C(s)+2NO(g)
N2(g)+CO2(g),下列说法能作 为判断该反应达到化学平衡状态标志的是
A. 容器内压强保持不变 B. v正(N2)=2v逆(NO)
C. N2与CO2的物质的量之比为1∶1 D. 容器内混合气体的密度保持不变
难度: 中等查看答案及解析
-
根据vt图分析外界条件改变对可逆反应A(g)+3B(g)
2C(g) ΔH<0的影响。该反应的速率与时间的关系如图所示:
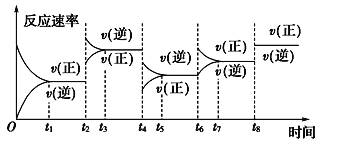
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,则下列对t2、t4、t6、t8时改变条件的判断正确的是
A. 使用了催化剂、增大压强、减小反应物浓度、降低温度
B. 升高温度、减小压强、减小反应物浓度、使用了催化剂
C. 增大反应物浓度、使用了催化剂、减小压强、升高温度
D. 升高温度、减小压强、增大反应物浓度、使用了催化剂
难度: 中等查看答案及解析
-
下表中物质的分类组合完全正确的是( )
编组
A
B
C
D
强电解质
NaCl
H2SO4
CaCO3
H2S
弱电解质
HF
BaSO4
HClO
NH3·H2O
非电解质
Cl2
CS2
CH4
蔗糖
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生反应:CO(g)+2H2(g)
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )

p2及195 ℃ 时n(H2)随时间变化
t/min
0
1
3
5
n(H2)/mol
8
5
4
4
A. p1>p2,ΔH<0
B. 在p2及195 ℃ 时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C. 在p2及195 ℃ 时,该反应的平衡常数为25
D. 在B 点时,v正>v逆
难度: 中等查看答案及解析
-
一定温度下,在三个体积均为 1.0L的恒容密闭容器中发生反应:2CH3OH(g) ⇌CH3OCH3(g) + H2O(g) 下列说法正确的是( )
容器
编号
温度(℃)
起始物质的量(mol)
平衡物质的量(mol)
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.20
0.080
0.080
II
387
0.40
III
207
0.20
0.090
0.090
A. 该反应的正反应为吸热反应
B. 达到平衡时,容器I中的CH3OH体积分数比容器II中的小
C. 容器I中反应到达平衡所需时间比容器III的长
D. 若起始时向容器I中充入0.15mol 的CH3OH、0.15mol 的CH3OCH3和0.10mol 的H2O,则反应将向正反应方向进行
难度: 中等查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器
甲
乙
丙
反应物投入量
1 mol N2、
3 mol H2
2 mol NH3
4 mol NH3
NH3的浓
度/mol·L-1
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
A. 2c1>c3 B. α1+α3<1 C. 2p2<p3 D. a+b>92.4
难度: 中等查看答案及解析