-
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
A. “洧水”的主要成分是油脂
B. “洧水”的主要成分是煤油
C. 烟的主要成分是炭黑
D. 烟的主要成分是石墨
难度: 中等查看答案及解析
-
将足量NO2通入下列各溶液中,所含离子还能大量共存的是( )
A. Fe2+、Cl-、SO42-、Na+ B. NH4+、Al3+、NO3-、Cl-
C. Ca2+、K+、Cl-、HCO3- D. K+、Na+、SO32-、SO42-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法错误的是( )
A. 一定条件下,2molSO2和1molO2混合在密闭容器中,充分反应后容器中的分子数大于2NA
B. 256gS8分子(结构如图)中含S-S键为7NA个
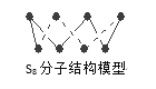
C. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D. 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
难度: 中等查看答案及解析
-
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
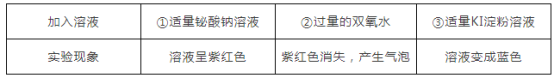
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
A. I2、H2O2、KMnO4、NaBiO3 B. H2O2、I2、NaBiO3、KMnO4
C. NaBiO3、KMnO4、H2O2、I2 D. KMnO4、NaBiO3、I2、H2O2
难度: 中等查看答案及解析
-
在试管中注入某浅红色溶液,加热试管,溶液红色加深,则原溶液可能是( )
①滴有石蕊的H2SO4溶液 ②滴有石蕊的NH4Cl溶液
③滴有酚酞的氨水溶液 ④滴有酚酞的Na2CO3溶液
A. ①② B. ②④ C. ①③ D. ③④
难度: 中等查看答案及解析
-
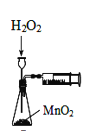
下列有关实验原理或实验操作正确的是( )
A. 将氯化铁固体溶于稀盐酸配制FeCl3溶液
B. 利用下图装置定量测定H2O2的分解速率
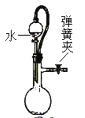
C. 如下图所示,关闭弹簧夹检查装置的气密性
D. 称取4.0gNaOH,放入100mL容量瓶中,加水稀释,配制1.0mol/L的NaOH溶液
难度: 中等查看答案及解析
-
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是
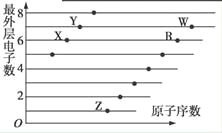
A. X和R在同一周期
B. 原子半径:W>R>X
C. 气态氢化物的稳定性:X>Y
D. X、Z形成的化合物中可能含有共价键
难度: 中等查看答案及解析
-
有一固体混合物,可能由K2CO3、NaNO2、FeCl3、KClO3、AgNO3混合而成,为检验它的成分,做了如下实验:(已知NaNO2不能被稀HNO3氧化)
①将固体溶于足量水,搅拌后静置,得到无色透明溶液和白色沉淀;
②取等量固体加入足量的稀硝酸中,有刺激性气味气体产生,同时有白色沉淀生成。
根据以上实验现象,你认为以下判断正确的是( )
A. 一定含有K2CO3、NaNO2、AgNO3
B. 无法判断是否含有FeCl3
C. 一定含有KClO3、NaNO2、AgNO3,不能肯定是否含有K2CO3
D. 是否含K2CO3,只要把实验②产生的气体通入少量澄清石灰水中,若没有变浑浊,则一定不含K2CO3
难度: 困难查看答案及解析
-
中学化学常见物质甲、乙、丙、丁之间存在如下转化关系:甲 + 乙 → 丙 + 丁。下列说法正确的是( )
A. 若甲为铜,丁为氯化亚铁,则乙一定是氯化铁
B. 若甲为碳,丁为硅,则丙一定是二氧化碳
C. 若甲为铝,丁为铁,则乙一定是氧化铁
D. 若甲为镁,丁为氢气,则乙一定是酸
难度: 中等查看答案及解析
-
与水一样,甲醇也能微弱电离:2CH3OH(l)
CH3OH2++CH3O-,25℃时,K=2.0×10-17。若往一定量的甲醇中加入金属钠,则有关叙述正确的是( )
A. 金属钠与甲醇反应比金属钠与水反应更剧烈
B. 结合H+的能力CH3O-<OH-
C. 所得到溶液中K=c(CH3O-)×c(CH3OH2+)
D. 所得到溶液中c(Na+)=c(CH3OH2+) + c(CH3O-)
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:

下列离子方程式正确的是( )
A. 少量CO2通入NaClO溶液中:CO2 + H2O + 2ClO-===CO32-+ 2HClO
B. 少量的SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ + 2ClO-===CaSO3↓+2HClO
C. 少量的SO2通入Na2CO3溶液中:SO2 + H2O + 2CO32-===SO32-+ 2HCO3-
D. 相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H+ + HCO3-===CO2↑+ H2O
难度: 中等查看答案及解析
-
已知NaHC2O4溶液显弱酸性,向100 mL0.1mol/L的NaHC2O4溶液中分别加入下列物质,有关说法正确的是( )
A. 加入少量H2C2O4固体,促进水电离,溶液中c(H+)增大
B. 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)
C. 加入氨水至中性,则溶液中:c(NH4+) + c(Na+)=2c(C2O42-) + c(HC2O4-)
D. 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2[c(H2C2O4) + c(HC2O4-) + c(C2O42-)]
难度: 中等查看答案及解析
-
电解NO制备NH4NO3的工作原理如图所示,X、Y皆Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A。下列说法正确的是( )
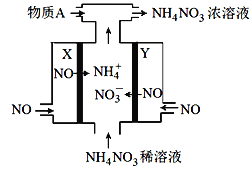
A. 物质A为NH3
B. X电极为电解池阳极
C. Y电极上发生了还原反应
D. Y电极反应式:NO-3e-+ 4OH-===NO3- +2H2O
难度: 中等查看答案及解析
-
臭氧的脱硝反应为:2NO2(g) + O3(g)
N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )

A. 反应2NO2(g) + O3(g)
N2O5(g) + O2(g) △S<0
B. 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb
C. 曲线b对应的条件改变可能是密闭容器的体积变为4.0L
D. 若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1
难度: 困难查看答案及解析
-
如图是向MgCl2、AlCl3混合溶液中,开始滴加7mL试剂A,之后改滴试剂B,所得沉淀y(mol)与试剂体积V(mL)间的关系.以下结论不正确的是( )
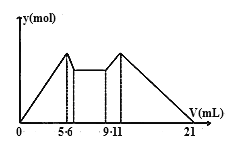
A. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=2︰1
B. 原混合液中,c(Al3+)︰c(Mg2+)︰c(Cl-)=1︰1︰5
C. A是NaOH,B是盐酸,且c(NaOH)︰c(HCl)=1︰2
D. 从6到9,相应离子反应式H+ + OH-===H2O
难度: 中等查看答案及解析




