-
下列叙述正确的是
A. 根据能量守恒定律,反应物的总能量等于生成物的总能量
B. 断裂化学键会释放能量
C. 放热的化学反应不需要加热就能发生
D. 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下所放出的热量相同
难度: 简单查看答案及解析
-
用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:4HCl(g)+O2(g)⇋2Cl2(g)+2H2O(g) ΔH=-115.6 kJ·mol-1。恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
A. 气体的质量不再改变
B. 氯化氢的转化率不再改变
C. 断开4 mol H-Cl键的同时生成4 mol H-O键
D. n(HCl):n(O2):n(Cl2):n(H2O)=4:1:2:2
难度: 中等查看答案及解析
-
由乙炔为原料制取CHClBr-CH2Br,下列方法中,最可行的是
A. 先与HBr加成后,再与HCl加成
B. 先与H2完全加成后,再与Cl2、Br2取代
C. 先与HCl加成后,再与Br2加成
D. 先与Cl2加成后,再与HBr加成
难度: 中等查看答案及解析
-
下列物质属于弱电解质的是
A. NaOH B. CH3COOH C. CO2 D. NH4Cl
难度: 中等查看答案及解析
-
下列溶液肯定呈酸性的是
A.含有H+的溶液 B.酚酞显无色的溶液
C.c(OH-)<c(H+)的溶液 D.pH小于7的溶液
难度: 中等查看答案及解析
-
下列设备工作时,将化学能转化为电能的是
A
B
C
D




硅太阳能电池
锂离子电池
太阳能集热器
燃气灶
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图所示各种装置中能构成原电池的是
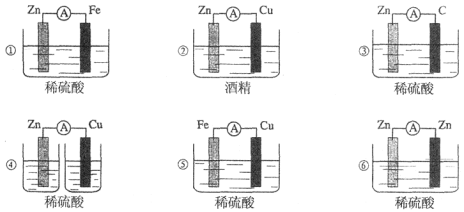
A.①②③ B.④⑤⑥ C.①③⑤ D.②④⑥
难度: 中等查看答案及解析
-
表示下列变化的化学用语正确的是
A. 氨水显碱性:NH3·H2O
NH4++OH-
B. 醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C. NaHCO3溶液显碱性:HCO3-+H2O
CO32-+OH-
D. 铁在潮湿空气中被腐蚀的负极反应:Fe-3e-=Fe3+
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A. 化学反应速率
B. KNO3的溶解度S
C. 化学平衡常数K D. 水的离子积常数Kw
难度: 中等查看答案及解析
-
反应C+CO2
2CO
H>0。升高温度,关于该反应v正和v逆的说法正确的是
A. v正增大,v逆减小 B. v正增大,v逆不变
C. 同时减小 D. 同时增大
难度: 中等查看答案及解析
-
如图所示原电池,盐桥中装有含琼胶的KCl饱和溶液,相关的叙述中,不正确的是
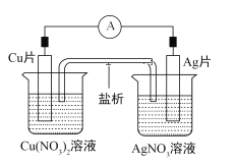
A. 盐桥中的K+向Cu片移动
B. 电子沿导线由Cu片流向Ag片
C. 正极的电极反应是Ag++e-=Ag
D. Cu片上发生氧化反应,Ag片上发生还原反应
难度: 简单查看答案及解析
-
用石墨作电极,电解下列物质的水溶液,其实质与电解水一致的是
A. NaCl B. NaOH C. CuSO4 D. CuCl2
难度: 中等查看答案及解析
-
二氧化硫的催化氧化反应:2SO2(g)+O2(g)
2SO3(g)是工业制硫酸的重要反应之一。下列说法错误的是
A. 煅烧硫铁矿(主要成分FeS2)可获得SO2,将矿石粉碎成细小颗粒可以提高反应的转化率
B. 已知该催化氧化反应K(300℃)>K(350℃),则该反应正向是放热反应
C. 该反应加入催化剂是为了加快反应速率
D. 保持温度不变,平衡后增大O2的浓度,该反应的平衡常数K不变
难度: 中等查看答案及解析
-
25℃时,若溶液中由水电离产生的c(OH-)=1×10-12 mol/L,则下列说法正确的是
A. 该溶液中水的电离被促进
B. 该溶液的pH一定为12
C. 该溶液中K+、Na+、Cl-、NO3-可以大量共存
D. 该溶液一定是NaOH溶液
难度: 中等查看答案及解析
-
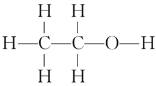
丙烯是一种常见的有机物。下列有关丙烯的化学用语中,不正确的是
A. 分子式C3H6
B. 结构简式CH2=CHCH3
C. 球棍模型
D. 聚合后的结构简式

难度: 中等查看答案及解析
-
下列变化与盐类水解平衡无关的是
A. 盐酸与碳酸钙反应生成二氧化碳 B. 将饱和氯化铁溶液加入沸水制胶体
C. 热的纯碱溶液除油污 D. 配制硫酸亚铁溶液时加少量硫酸
难度: 中等查看答案及解析
-
25℃时,下列有关0.1 mol·L-1醋酸溶液的说法中,正确的是
A.pH = 1
B.c(H+) = c(CH3COO-)
C.加入少量CH3COONa固体后,醋酸的电离程度减小
D.与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液显中性
难度: 简单查看答案及解析
-
下列关于乙烯和乙烷相比较的说法中,不正确的是
A. 乙烯属于不饱和烃,乙烷属于饱和烃
B. 乙烯和乙烷互为同系物
C. 乙烷在光照条件下能与Cl2发生取代反应,乙烯则不能
D. 乙烯能使Br2的CCl4溶液褪色,乙烷则不能
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)
H=a kJ·moL-1,反应能量变化如图所示。下列说法中,不正确的是
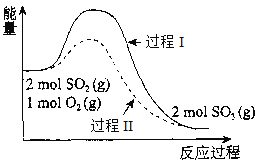
A. a<0
B. 过程II可能使用了催化剂
C. 反应物断键吸收能量之和小于生成物成键释放能量之和
D. 使用催化剂可以提高SO2的平衡转化率
难度: 中等查看答案及解析
-
下列各组物质互为同分异构体的是
A. 35Cl与37Cl
B.
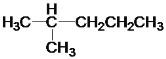 与
与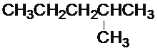
C.
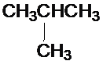 与CH3(CH2)2CH3
与CH3(CH2)2CH3D.
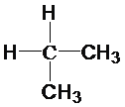 与
与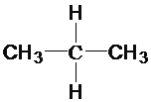
难度: 中等查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是
A. 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B. pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C. 足量AgCl固体置于同浓度的CaCl2和NaCl溶液,两溶液中银离子浓度相同
D. pH=5.6的CH3COOH与CH3COONa混合溶液,c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析
-
铅蓄电池是常见的二次电池,电池总反应为:Pb+PbO2+2H2S4
2PbSO4+2H2O,下列说法正确的是
A. 放电时的负极反应式为Pb+SO42- -2e-=PbSO4
B. 充电时铅蓄电池的正极与外接电源的负极相连
C. 放电时PbO2发生氧化反应
D. 充电时的阴极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+
难度: 中等查看答案及解析
-
下列图示与文字叙述相符合的是
A
B
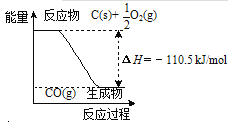
12 g C(s)与一定量O2(g)反应生成14 g
CO(g),放出的热量为110.5 kJ
热水浴的烧瓶中气体颜色较浅
C
D
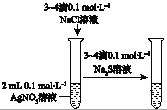
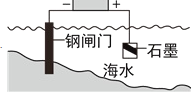
验证AgCl溶解度大于Ag2S
钢闸门作为阴极而受到保护
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
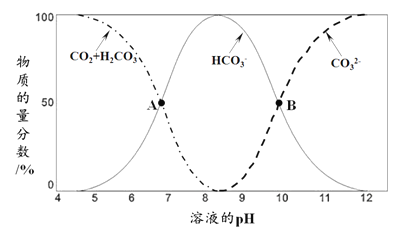
已知氯水中存在反应:Cl2+H2O
H++Cl-+HClO,取5 mL饱和氯水进行如下实验。下列说法中,正确的是
A. 加5 mL水,c (H+)增大
B. 加少量NaCl固体,c (H+)不变
C. 加少量碳酸钙粉末,c(HClO)升高
D. 加少量Na2SO3固体,溶液pH升高
难度: 中等查看答案及解析
-
将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-
2Fe2++I2”的是
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A. ①和② B. ②和④ C. ③和④ D. ①和③
难度: 中等查看答案及解析
-
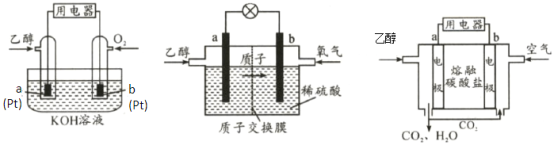
利用右图所示装置可以将温室气体CO2转化为燃料气体CO。下列说法中,正确的是
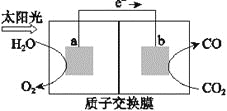
A. 该过程是将太阳能转化为化学能的过程
B. 电极a表面发生还原反应
C. 该装置工作时,H+从b极区向a极区移动
D. 该装置中每生成1 mol CO,同时生成1 mol O2
难度: 中等查看答案及解析
-
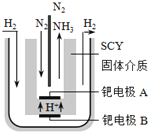
如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700—900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是
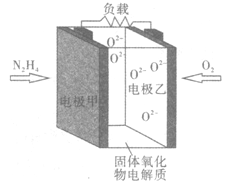
A. 电池总反应为N2H4+2O2=2NO+2H2O
B. 电池内的O2-由电极乙移向电极甲
C. 电极乙上反应的电极方程式为:O2+2e-=O2-
D. 电池外电路的电子由电极乙移向电极甲
难度: 中等查看答案及解析
-
已知A(g)+B(g)
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B,反应初始4 s内A的平均反应速率υ(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4 s时c(B)为0.38 mol/L
B. 830℃达平衡时,A的转化率为20%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应C(g)+D(g)
A(g)+B(g)的平衡常数为0.4
难度: 中等查看答案及解析
-
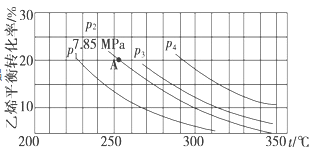
密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i. CO(g)+2H2(g)
CH3OH(g)
H1=-90.1 kJ·mol-1
ii. 2CH3OH(g)
CH3OCH3(g)+H2O(g)
H2=-24.5 kJ·mol-1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X的变化曲线如下图所示。下列说法正确的是
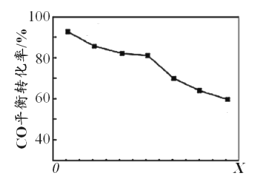
A. 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
难度: 困难查看答案及解析
-
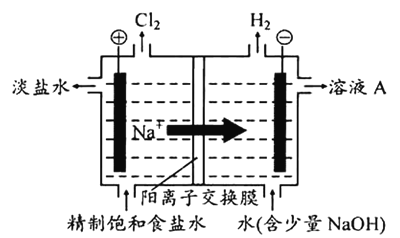
工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s)+CO32-(aq)
PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 整个过程涉及一个复分解反应和两个氧化还原反应
D. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
难度: 中等查看答案及解析
-
2016年我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如下图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是
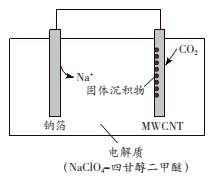
A. “吸入”CO2时,钠箔为正极
B. “呼出”CO2时,Na+向多壁碳纳米管电极移动
C. “吸入”CO2时的正极反应:4Na++3CO2+4e-=2Na2CO3+C
D. 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
难度: 简单查看答案及解析
 与氢气反应的化学方程式是__________;
与氢气反应的化学方程式是__________; 、
、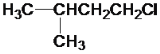 、_________、_________。
、_________、_________。