-
科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)
1918年,德国化学家哈伯因发明工业合成氨的方法而荣获诺贝尔化学奖。
(1)若将1 mol N2和3 mol H2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为________mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是________________。
a. υ(N2)正=3υ(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)若1 mol N2完全转化为NH3的反应热为 H=-92 kJ/mol,拆开1 mol H—H键和1 mol N
H=-92 kJ/mol,拆开1 mol H—H键和1 mol N N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。
(4)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)
1998年,两位希腊化学家提出了电解合成氨的新思路:
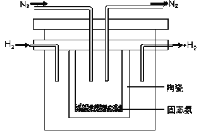
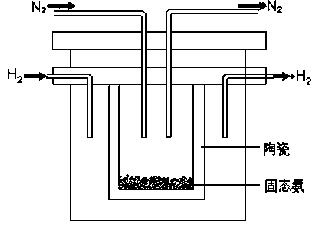
采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
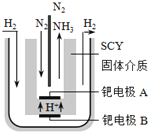
钯电极A是电解池的________极(填“阳”或“阴”),阳极反应式为__________________。
(方法三)
最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92 kJ/mol
H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1)  H=-571.6 kJ/mol
H=-571.6 kJ/mol
写出上述固氮反应的热化学方程式________________________________。
-
科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)1918年,德国化学家哈伯因发明工业合成氨(N2(g)+3H2(g) 2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
(1)若将1molN2和3molH2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为_____mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是____。
a. v(N2)正=3v(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)1998年,两位希腊化学家提出了电解合成氨的新思路:
(4)采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
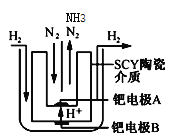
钯电极A是电解池的___极(填“阳”或“阴”),阳极反应式为________。
(方法三)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g)  2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
(5)写出上述固氮反应的热化学方程式___________。
-
(14分)科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为: 
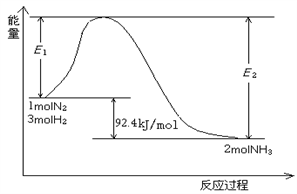
该反应的能量变化如图所示。
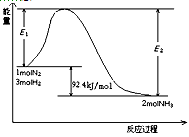
①在反应体系中加入催化剂,反应速率增大,E2的变化是:________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:

5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=________,H2的转化率为________,该反应在此温度下的化学平衡常数为________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为________。

(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
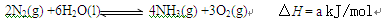
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a________0。(填“大于”、“小于”或“等于”)
-
(14分)科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:
该反应的能量变化如图所示。
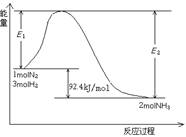
①在反应体系中加入催化剂,反应速率增大,E2的变化是:________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应: 
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=________,H2的转化率为________,该反应在此温度下的化学平衡常数为________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为________。
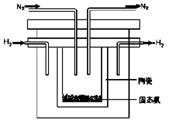
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:

进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a________0。(填“大于”、“小于”或“等于”)
-
(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
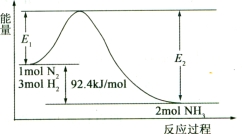
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
-
科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:N2(g)+3H2(g) 2NH3(g) △H,该反应的能量变化如图所示:
2NH3(g) △H,该反应的能量变化如图所示:
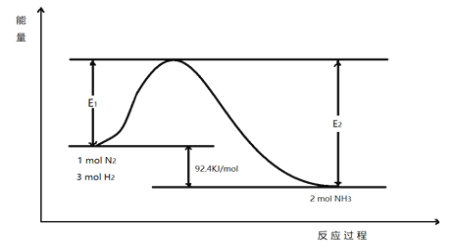
在反应体系中加入催化剂,反应速率增大,E2的变化是:____。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g) 2NH3(g),5分钟后达到平衡,测得N2为0.2mol,H2为0.6mol,NH3为0.2mol。氮气的平均反应速率v(N2)=____,H2的转化率为_____,该反应在此温度下的化学平衡常数为_____(后两空保留小数点后一位)。
2NH3(g),5分钟后达到平衡,测得N2为0.2mol,H2为0.6mol,NH3为0.2mol。氮气的平均反应速率v(N2)=____,H2的转化率为_____,该反应在此温度下的化学平衡常数为_____(后两空保留小数点后一位)。
③欲提高②容器中H2的转化率,下列措施可行的是_____。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为_______。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:2N2(g) +6H2O(l) 4NH3(g) +3O2(g) △H = a kJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
4NH3(g) +3O2(g) △H = a kJ/mol,进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_____0。(填“大于”、“小于”或“等于”)
-
(3分)科学家一直致力于“人工固氮” 的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个1L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为1 mol·L-1,并放出Q kJ热量,该反应的热化学方程式可表示为 ____ __。
-
科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原理为:N2(g)+3H2(g) 2NH3(g) △H 该反应的能量变化如图所示。
2NH3(g) △H 该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是:______________。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=_______________,H2的转化率为_______________,该反应在此温度下的化学平衡常数为_______________。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是____________。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.液化生成物分离出氨
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为_____________________。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应:
2N2(g) +6H2O(l)  4NH3(g) +3O2(g) △H = a kJ/mol
4NH3(g) +3O2(g) △H = a kJ/mol
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a_________0。(填“大于”、“小于”或“等于”)
-
科学家一直致力于“人工固氮”的方法研究.用N2和H2合成NH3的能量变化如图所示。

(1)合成氨反应的热化学方程式_________________________,已知E2=212.4kJ/mol,则该反应正反应的活化能是______。
(2)反应体系中加入催化剂,反应速率______,E2的变化是______。(填“增大”、“减小”或“不变”)
(3)工业上常采用高温高压,使用催化剂的方法改变该反应的反应速率,在甲乙两个体积均为2L固定容积的密闭容器中,分别充入1molN2、3molH2和1molN2、3molH2、1molHe,反应速率甲__乙(填大于、小于或等于)。
(4)该反应的△S______0,(填大于、小于或等于),理论上在______条件下可以自发。
-
1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2 2NH3,有关说法正确的是
2NH3,有关说法正确的是
A.不同的催化剂对化学反应速率影响均相同
B.新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C.新法合成能在常温下进行是因为不需要断裂化学键
D.哈伯法合成氨是吸热反应,新法合成氨是放热反应
H=-92 kJ/mol,拆开1 mol H—H键和1 mol N
N 键需要的能量分别是436 kJ和946 kJ,则拆开1 mol N—H键需要的能量是__________kJ。

2NH3(g)
H=-92 kJ/mol
H=-571.6 kJ/mol


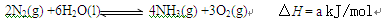



 2NH3(g) △H,该反应的能量变化如图所示:
2NH3(g) △H,该反应的能量变化如图所示:

 2NH3(g) △H 该反应的能量变化如图所示。
2NH3(g) △H 该反应的能量变化如图所示。

