-
下列相关反应的离子方程式书写正确的是
A. 氢氧化铁溶于氢碘酸:Fe(OH)3+3H+ =Fe3++3H2O
B. 氯化铝溶液中滴加过量的氨水:Al3++4 NH3·H2O=AlO2-+4NH4++2H2O
C. NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=Al(OH)3↓+2BaSO4↓+ NH3·H2O
D. NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH- =BaCO3↓+2H2O+ CO32-
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。X的气态氢化物常用作制冷剂。ZYW2能与水剧烈反应,可观察到液面上有雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是
A. 最简单氢化物的沸点:Z>Y
B. 原子半径:W>Z>Y>X
C. 把ZY2通入石蕊试液中先变红后褪色
D. 向ZYW2与水反应后的溶液中滴加AgNO3溶液有白色沉淀生成
难度: 中等查看答案及解析
-
中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
难度: 简单查看答案及解析
-
下列是三种有机物的结构简式,下列说法正确的是( )
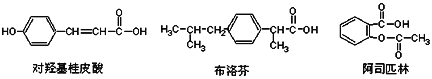
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 三种物质中,其中有两种互为同分异构体
D. 三种物质在一定条件下,均可以被氧化
难度: 中等查看答案及解析
-
质子交换膜燃料电池(简称:PEMFC),又称固体高分子电解质燃料电池,是一种以含氢燃料与空气作用产生电力与热力的燃料电池,膜极组和集电板串联组合成一个燃料电池堆。目前,尤以氢燃料电池倍受电源研究开发人员的注目。它的结构紧凑,工作温度低(只有80℃),启动迅速,功率密度高,工作寿命长。工作原理如图,下列说法正确的是( )

A. 可用一氧化碳、甲烷代替图中氢气和氧气(空气)形成质子交换膜燃料电池。
B. B极的电极反应式为:O2+4H++4e-=2H2O
C. 用该电池作为精炼铜的电源时,A极与粗铜电极相连
D. 当外电路中转移0.1mole−时,通过质子交换膜的H+的数目为0.2NA
难度: 中等查看答案及解析
-
下列实验操作规范且能达到相应实验目的的是( )
选项
实验目的
实验操作
A
证明Ksp(BaSO4)<Ksp(BaCO3)
向BaCO3溶液中加入饱和Na2SO4溶液
B
分离KClO3与MnO2制取后的残渣
溶解、过滤、洗涤干燥滤渣得到MnO2,滤液蒸发结晶并干燥得到KClO3
C
配制100 g 4%的NaOH溶液
称取4.0gNaOH放在烧杯中,再加入96.0mL水,搅拌均匀
D
检验Al和Fe2O3反应后固体中是否含Fe2O3
取样,溶于足量稀硫酸,滴加KSCN溶液不变红,说明不含Fe2O3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,向10mL1mol·L-1元酸HA溶液中,不断滴加1mol·L-1的NaOH溶液所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是

A. 常温下,Kα(HA)的数量级为10-4
B. a、b两点pH均为7
C. 从a点到b点,水的电离程度先增大后减小
D. 溶液的导电性逐渐增强
难度: 中等查看答案及解析
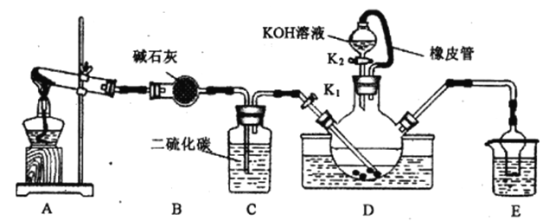
 NH4SCN+H2S。该反应比较缓慢。
NH4SCN+H2S。该反应比较缓慢。


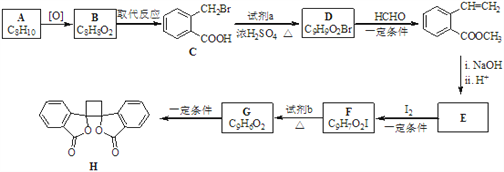
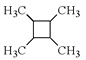 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________