-
某小组以黄铜矿(主要成分为 CuFeS2,含少量SiO2等杂质)为原料制备铜化工产品CuAlO2的一种工艺如下:
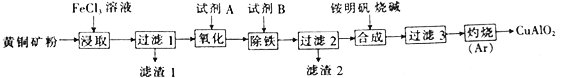
已知①过滤1所得滤液中含金属离子有:Cu2+、Fe2+和Fe3+,滤渣1的主要成分是SiO2和S;
②Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
(1)从产品纯度、环保操作方便等角度考虑,试剂A、B的最佳组合是__________(填代号)
| a | b | c | d |
| A | HNO3 | NaClO | H2O2 (酸化) | H2O2 (酸化) |
| B | Cu(OH)2 | NaOH | 氨水 | Cu(OH)2 CO3 |
(2)铵明矾的化学式为NH4Al(SO4)2·12H2O,它为制备铜的化工产品提供铝源。铵明矾溶液中NH4+、A13+、H+、OH-、SO42-浓度大小排序为_______________。
(3)过滤3得到A1(OH)3和Cu(OH)2,写出“灼烧”发生化学反应的方程式:_________________。
(4)单位时间内“浸取”Cu2+的百分率(称为浸出率)与溶液浓度、温度关系如下图所示。
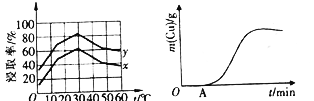
在20℃时,1L溶液中有效碰撞总次数:x_________y(填“>”“<”或“=”)。相同浓度下,温度高于30℃,“浸出率”降低的主要原因是_________________。
(5)以铜、石墨为电极,电解“过滤1”所得溶液制备铜,铜的质量与通电时间关系如上图所示。写出OA段阴极的反应方程式:___________________________。
(6)常温下,Ksp[Fe(OH)3]=4.0×10-38。加入试剂B调节pH=3时c(Fe3+)=_________mol/L
-
辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
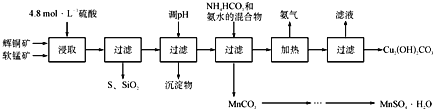
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算):
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe 3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有____________________(任写一点);
(2)调节浸出液pH的范围为____________,其目的是_______________________;
(3)本工艺中可循环使用的物质是____________________(写化学式).
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成_________________的结果;
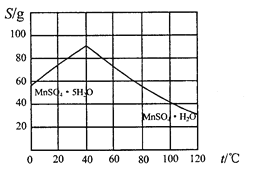
(5)碳酸锰在一定条件下可得硫酸锰溶液,试根据如下曲线图示,现由硫酸锰溶液制备MnSO4·H2O的实验方案为____________________。
(6)用标准BaCl2溶液测定样品中MnSO4•H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有_________________(任写一种)。
-
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
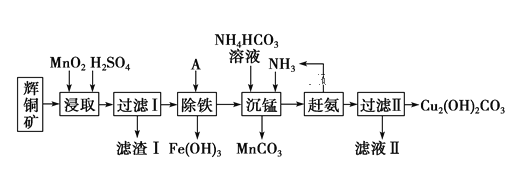
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除将辉铜矿粉碎外,还可采取的措施有______________________(任写一种)。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_____________,若加 A 后溶液的 pH调为5,则溶液中 Fe3+的浓度为_____________mol/L。
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:____________________。
(4)“赶氨”时,最适宜的操作方法是______________________。
-
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
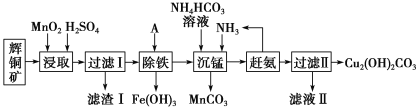
已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)滤渣I中的主要成分除了MnO2,S还有___________ (化学式),请写出“浸取”反应中生成S的化学方程式:_____。
(2)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为____,若加A后溶液的pH调为5,则溶液中Fe3+的浓度为____mol/L。
(3)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_____。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是____(写化学式)。
-
铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
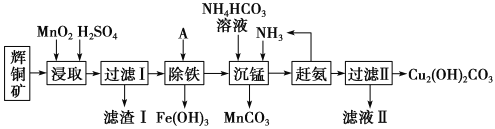
已知:
①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=2.0×10-36
③Cu2S遇酸时会生成S
(1)加快“浸取”速率,除适当增加硫酸浓度外,还可采取的措施有__________(任写一种)。
(2)滤渣I中的主要成分是______________。
(3)常温下“除铁”时加入的试剂A可用CuO等,调节pH调的范围为_______,请用离子方程式表示用CuO“除铁”时所发生的反应__,若加A调节溶液pH后溶液中Fe3+的浓度为2.0×10-9mol/L,则pH为__。
(4)写出“沉锰”(除Mn2+)过程中反应的离子方程式:_________________________。
(5)Na2CO3溶液浸泡重晶石(假设杂质不与Na2CO3反应),能将BaSO4转化为BaCO3,此反应的平衡常数K= ________(填写计算结果);若不考虑CO32-的水解,要使46.6g BaSO4恰好完全转化为BaCO3,则至少需要浓度为1mol·L-1Na2CO3溶液 ____mL。(已知:Ksp(BaSO4)=1.0×10-10、Ksp(BaCO3)=5.0×10-9)
-
Ⅰ.辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如图:
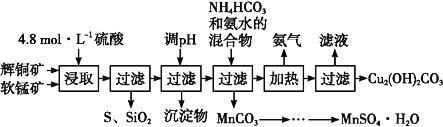
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
| 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有________________(任写一种)。
(2)调节浸出液pH的范围为________,其目的是 ____________________。
(3)本工艺中可循环使用的物质是________(写化学式)。
(4)在该工艺的“加热驱氨”环节,若加热的温度较低或过高,都将造成__________的结果。
Ⅱ.海水开发利用的部分过程如下图所示。
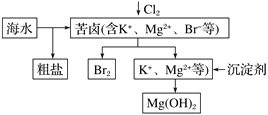
(1)海水中提取的NaCl中若混有少量的KClO3固体(KClO3溶解度随温度变化大),可通过______、________、_________的操作净化。
(2)生成Mg(OH)2用的沉淀剂一般是生石灰或熟石灰,所以Mg(OH)2沉淀中会混有Ca(OH)2,可通过反复洗涤去除Ca(OH)2,检验沉淀是否洗净的操作方法_______________。
-
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验
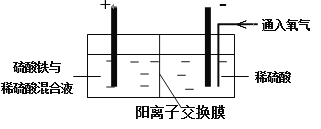
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
-
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并 加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
① 阳极区硫酸铁的主要作用是 。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。
写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
-
以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ. 将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ. 采用如下装置进行电化学浸出实验

将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ. 一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+Cu2+(水相) R2Cu(有机相)+2H+(水相)
R2Cu(有机相)+2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ. 电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
①阳极区硫酸铁的主要作用是 。
②电解过程中,阳极区Fe3+的浓度基本保持不变,原因是 。
(2)阴极区,电极上开始时有大量气泡产生,后有固体析出,一段时间后固体溶解。写出上述现象对应的反应式 。
(3)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 ;加入有机萃取剂的目的是 。
(4)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 。
(5)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 。(忽略电解前后溶液体积的变化)
-
在实验室模拟工业上以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验
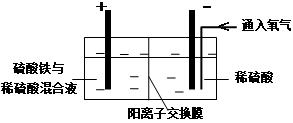
将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(1)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2+4H+=Cu2++Fe2++2H2S
2Fe3++H2S=2Fe2++S↓+2H+
① 阳极区硫酸铁的主要作用是 _____________。
② 电解过程中,阳极区Fe3+的浓度基本保持不变,原因是_____________。(使用化学用语作答)
(2)若在实验室进行步骤Ⅲ,分离有机相和水相的主要实验仪器是 _____________;加入有机萃取剂的目的是___________________。
(3)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是 _____________。
(4)步骤Ⅳ,若电解200mL0.5 mol/L的CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ___________________。(忽略电解前后溶液体积的变化)












