-
盐类水解在工农业生产和日常生活中有着广泛的应用,有关应用或说法与盐类水解无关的是
A. 用热的纯碱溶液洗涤餐具上的油污
B. 生活中常用明矾净水
C. 用稀硫酸或浓氨水除去铜器表面的铜绿
D. 长期使用硫酸铵化肥的土壤,易变酸性,可施用适量的熟石灰
难度: 简单查看答案及解析
-
下列各组元素,按照原子半径依次减小、第一电离能依次增大的顺序排列的是
A. K、Na、Li B. Al、Mg、Na C. N、O、C D. P、S、Cl
难度: 简单查看答案及解析
-
下列变化需要吸收能量的是
A.1s22s22p63s1→1s22s22p6
B.3S23P5→3S23P6
C.2Px22py12pz1→2Px12py12pz2
D.2H→H-H
难度: 简单查看答案及解析
-
生活中的下列现象与原子核外电子发生跃迁有关的是
A. 钢铁长期使用后生锈 B. 节日里燃放的焰火
C. 金属导线可以导电 D. 卫生丸久置后消失
难度: 简单查看答案及解析
-
下列有关物质性质或应用的说法正确的是
A. 医疗上,常用碳酸钠治疗胃酸过多
B. 在海轮外壳上安装锌块以减缓船体腐蚀
C. 液氨汽化放出大量的热,可用作制冷剂
D. 明矾具有强氧化性,常用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
下列说法正确的是
A. Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. 泡沫灭火器中常使用的原料是碳酸氢钠和硫酸铝
D. 为绘制中和滴定曲线,在滴定过程中,每隔相同时间用pH计测定一次锥形瓶中溶液的pH
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应A(g)
B(g)+C(g),若反应物的浓度由2 mol·L-1降到0.8m01·L一1需要20s,那么反应物浓度再由0.8 mol·L-1降到0.2 mol·L-1所需要的时间为
A. l0s B. 大于10s C. 小于10s D. 无法判断
难度: 中等查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.
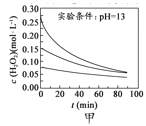 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快B.
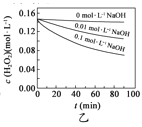 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快C.
 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快D.

 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大难度: 中等查看答案及解析
-
下列图示与对应的叙述不相符合的是
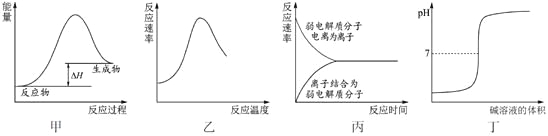
A. 图甲表示燃料燃烧反应的能量变化
B. 图乙表示酶催化反应的反应速率随反应温度的变化
C. 图丙表示弱电解质在水中建立电离平衡的过程
D. 图丁表示强碱滴定强酸的滴定曲线
难度: 中等查看答案及解析
-
用物质的量都是0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该溶液的下列判断正确的是
A. c(H+)>c(OH-) B. c(CH3COO-)=0.1 mol·L-1
C. c(CH3COOH)>c(CH3COO-) D. c(CH3COO-)+c(OH-)=0.1 mol·L-1
难度: 困难查看答案及解析
-
在恒温下的密闭容器中,有可逆反应2NO(g)+O2(g)
2NO2(g);ΔΗ<0,不能说明已达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成O2的速率相等
B. 混合气体颜色深浅保持不变
C. 反应器中压强不随时间变化而变化
D. 混合气体平均分子量保持不变
难度: 困难查看答案及解析
-
在一定条件下,Na2CO3溶液存在CO32—+ H2O
HCO3—+OH—平衡。下列说法不正确的是
A. 稀释溶液,
增大 B. 通入CO2,溶液PH减小
C. 升高温度,此平衡常数增大 D. 加入NaOH固体,
减小
难度: 中等查看答案及解析
-
在其它条件一定时,图中曲线表示反应2NO(g)+ O2(g)
2NO2(g) △H>0达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正>V逆的点是
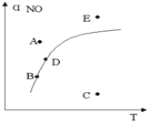
A. A或E B. B点
C. C点 D. D点
难度: 中等查看答案及解析
-
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
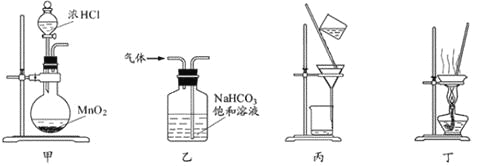
A. 用装置甲制取氯气
B. 用装置乙除去氯气中的少量氯化氢
C. 用装置丙分离二氧化锰和氯化锰溶液
D. 用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 常温时,在c(H+)=
的溶液:Na+、Al3+、Cl-、S2-
B. 由水电离的c(H+)=10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. c(OH-)/c(H+)=10-12的溶液中:NH4+、Al3+、NO3-、Cl-
D. 加入金属铝能放出大量H2的溶液:NH4+、K+、HCO3-、CH3COO-
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 氨水稀释后,溶液中
的值减小
B. 0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH增大
C. 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D. 298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
难度: 中等查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是
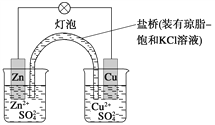
A. 正极反应为:Zn-2e-===Zn2+
B. 电池反应为:Zn+Cu2+===Zn2++Cu
C. 在外电路中,电子从正极流向负极
D. 盐桥中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1 mol·L-1CH3COONa溶液和0.1 mol·L-1 HCl溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B. 0.1 mol·L-1 NH4Cl溶液和0.1 mol·L-1 氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液等体积混合:
c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
D. 0.1 mol·L-1 Na2C2O4溶液和0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):
难度: 困难查看答案及解析


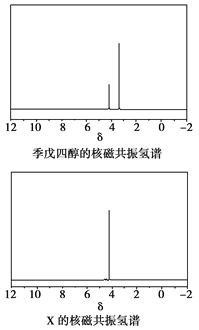
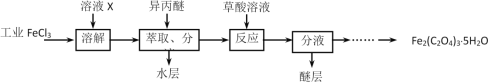
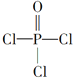 )与季戊四醇(
)与季戊四醇(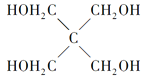 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: