-
下列有关能源的理解或说法错误的是
A. 煤、石油、太阳能、风能等均属于新能源
B. 乙醇是一种可再生能源,可代替汽油作为汽车燃料
C. 氢气是最轻的燃料,是具有广阔发展前景的能源
D. 研发开采可燃冰(水合甲烷)的技术,可大大缓解能源危机
难度: 简单查看答案及解析
-
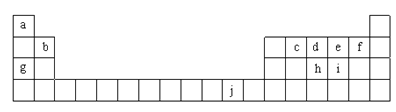
下列元素位于p区的是
A. Ti B. Cu C. S D. Na
难度: 简单查看答案及解析
-
若某原子的外围电子排布式为4d15s2,则下列说法正确的是
A. 该元素位于周期表中第五周期IIIB族 B. 该元素原子价电子数为2个
C. 该元素为非金属元素 D. 该元素原子N能层共有8个电子
难度: 中等查看答案及解析
-
下列有关物质性质的比较中,不正确的是
A. 热稳定性:HF<HCl B. 碱性:KOH>Mg(OH)2
C. 酸性:HClO4>H2SO4 D. 熔点:Na>K
难度: 中等查看答案及解析
-
下列分子或离子的空间构型为平面三角形的是
A. NO3- B. H3O+ C. SO32 - D. SiH4
难度: 中等查看答案及解析
-
下列各组分子中,都由极性键构成的极性分子的一组是
A. C3H6和CO2 B. CCl4和H2S C. H2O和NH3 D. H2O2和CS2
难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物是离子化合物的是
A. 可溶于水 B. 具有较高的熔点
C. 水溶液能导电 D. 固体不导电,熔融状态能导电
难度: 中等查看答案及解析
-
已知:原子序数小于18的同一主族的两种元素X和Y,其原子半径:X<Y。下列说法正确的是
A. 若X和Y均位于VIIA,则键能大小为HX<HY
B. 若X和Y均位于VIA,则H2X分子间易形成氢键
C. 若X和Y均位于IVA,则二者最高价氧化物的晶体类型相同
D. 若X和Y均位于IIA,则第一电离能大小为X<Y
难度: 中等查看答案及解析
-
已知MgCO3 、CaCO3、SrCO3、BaCO3受热均要分解。下列说法不正确的是
A. 上述四种盐的晶体均属于离子晶体 B. 分解所得金属氧化物晶格能最大的是MgO
C. 分解所需温度最低的是BaCO3 D. 所得的气态产物的VSEPR模型是直线形
难度: 中等查看答案及解析
-
下列有关金属的说法中正确的是
A. 金属原子的核外电子在金属晶体中都是自由电子
B. 镁型和铜型的原子堆积方式空间利用率最高
C. 金属原子在化学变化中失去的电子数越多,其还原性越强
D. 温度升高,金属的导电性将变大
难度: 中等查看答案及解析
-
现有四种元素基态原子电子排布式如下:
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5.则下列有关比较中正确的是
A. 单电子数:③>① B. 原子半径:④>③
C. 电负性:②>① D. 最高正化合价:④>①
难度: 中等查看答案及解析
-
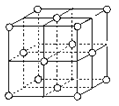
有关晶体的结构如图所示,下列说法中不正确的是( )
A.
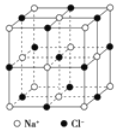 在NaCl 晶体中,距Na+最近的Cl-形成正八面体
在NaCl 晶体中,距Na+最近的Cl-形成正八面体B.
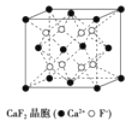 在CaF2 晶体中,每个晶胞平均占有4 个Ca2+
在CaF2 晶体中,每个晶胞平均占有4 个Ca2+C.
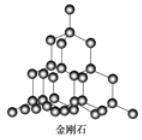 在金刚石晶体中,碳原子与碳碳键个数的比为1:2
在金刚石晶体中,碳原子与碳碳键个数的比为1:2D.
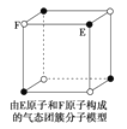 该气态团簇分子的分子式为EF或FE
该气态团簇分子的分子式为EF或FE难度: 简单查看答案及解析
-
下列事实不能用化学平衡移动原理解释的是
A. 光照新制的氯水时,溶液的pH逐渐减小
B. 加催化剂,使N2和H2在一定条件下转化为NH3
C. 可用浓氨水和氢氧化钠固体快速制取氨气
D. 增大压强,有利于SO2和O2反应生成SO3
难度: 中等查看答案及解析
-
下列内容与结论相对应的是
选项
内容
结论
A
H2O(g)变成H2O(l)
ΔS>0
B
硝酸铵溶于水可自发进行
因为ΔS<0
C
一个反应的ΔH>0,ΔS>0
反应一定不自发进行
D
H2(g)+F2(g)===2HF(g) ΔH=-271 kJ·mol-1
ΔS=8 J·mol-1·K-1
反应在任意外界条件下均可自发进行
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
恒温恒容条件下,不能表明反应: 2NO2(g)
2NO(g)+O2(g) 已达平衡状态的是
A. 容器中颜色不再改变 B. 混合气平均相对分子质量不再改变
C. 混合气密度不再改变 D. 单位时间内生成n mol O2的同时生成2n mol NO2
难度: 中等查看答案及解析
-
已知:键能数据如下:
H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
243
a
下列有关H2(g)与Cl2(g)反应生成HCl(g)的说法正确的是
A. H2(g)与Cl2(g)热化学方程式可表示为:H2(g)+Cl2(g)=2HCl(g) △H=(2a-679)kJ/mol
B. H2(g)与Cl2(g)反应 一定是放热反应
C. 若a=431,则反应生成2molHCl时的△H=183kJ/mol
D. 反应物的总能量小于生成物的总能量
难度: 中等查看答案及解析
-
在容积不变的密闭容器中进行反应:X2(g)+3Y2(g)
2Z2(g),若X2、Y2、Z2的初始物质的量浓度分别为0.10mol·L-1、0.30mol·L-1、0.20mol·L-1,当反应达到平衡时Z2的物质的量浓度不可能是
A. 0.05mol·L-1 B. 0.20mol·L-1 C. 0.35mol·L-1 D. 0.40mol·L-1
难度: 简单查看答案及解析
-
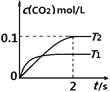
对于可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
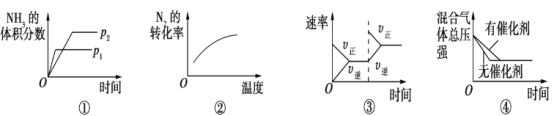
A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A的浓度降低为0.30mol/L.下列有关判断正确的是
A. C的体积分数增大了 B. A的转化率降低了
C. 平衡向正反应方向移动 D. x+y<z
难度: 简单查看答案及解析
-
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
① CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ/mol
② CH3OH(g)+
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ/mol
下列说法正确的是 ( )
A. CH3OH的燃烧热为192.9 kJ/mol
B. 反应①中的能量变化如图所示
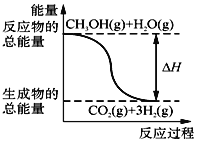
C. CH3OH转变成H2的过程一定要吸收能量
D. 根据②推知反应:CH3OH(l)+
O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ/mol
难度: 简单查看答案及解析
-
在10L 恒容密闭容器中充入X(g)和Y(g),发生:X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法中不正确的是
A. 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-3mol/(L·min)
B. 实验④中,达到平衡时,b>0.060
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验②中,该反应的平衡常数K=1.0
难度: 中等查看答案及解析