-
按要求回答下列问题:
(1)在下列物质中:①NaOH ②Na2O2 ③(NH4)2S ④CCl4 ⑤H-C≡C-H ⑥SiC ⑦晶体硅。含有非极性键的分子晶体是______,既有离子键,又有极性键和配位键的离子晶体是_____,原子晶体中熔点较高的是______(以上均填写序号)。
(2)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g)  CH3OH(g) +H2O(g) ΔH2
CH3OH(g) +H2O(g) ΔH2
①上述反应中原子利用率百分之百的是____(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1________0,T℃时,将2 mol CO和6 molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,此时T为____________。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________。
-
(6分)在下列物质中:①NaCl ②NaOH ③Na2O2 ④CH2O ⑤(NH4)2S ⑥CCl4 ⑦C2H2 ⑧SiC ⑨晶体硅 ⑩金刚石 (选填序号)
(1)其中只含有离子键的离子晶体是________;
(2)其中既有离子键,又有极性键和配位键的离子晶体是________;
(3)其中既有离子键,又有非极性键的是 ________;
(4)其中含有非极性键的非极性分子的是 ________ ;
(5)其中所有原子都在同一平面上的分子有 ________;
(6)其中含有极性键的的原子晶体是________;
-
在下列物质中:①SiO2 ②NaOH ③Na2S ④H2O2 ⑤Na2O2 ⑥(NH4)2S ⑦CO2 ⑧CCl4 ⑨C2H4 ⑩金刚石.用序号填空:
(1)只含有离子键的是 _____;
(2)既含有离子键,又含有极性共价键和配位键的是 _____;
(3)既含有离子键又含有非极性共价键的是 _______;
(4)含有极性共价键和非极性共价键的非极性分子是 _____;
(5)含有极性共价键和非极性共价键的极性分子是 _________;
(6)熔化时只破坏极性共价键的是 _______
-
在下列物质中:①SiO2 ②NaOH ③Na2S ④H2O2 ⑤Na2O2 ⑥(NH4)2S ⑦CO2⑧CCl4 ⑨C2H4 ⑩金刚石。用序号填空:
(1)只含有离子键的是______________________________________;
(2)既含有离子键,又含有极性共价键和配位键的是____________;
(3)既含有离子键又含有非极性共价键的是____________________;
(4)含有极性共价键和非极性共价键的非极性分子是____________;
(5)含有极性共价键和非极性共价键的极性分子是_______________;
(6)熔化时只破坏极性共价键的是_____________________________。
-
下列有关化学键类型的判断正确的是( )
A. 全部由非金属元素组成的化合物中肯定不存在离子键
B. 所有物质中都存在化学键
C. 已知乙炔的结构式为H—C≡C—H,则1个乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D. 乙烷分子中只存在σ键,即C—H键和C—C键都为σ键,不存在π键
-
下列有关化学键类型的判断正确的是( )
A. 全部由非金属元素组成的化合物中肯定不存在离子键
B. 所有物质中都存在化学键
C. 已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D. 乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
-
下列有关化学键类型的叙述正确的是( )
A.全部由非金属构成的化合物中肯定不存在离子键
B.所有物质中都存在化学键
C.已知乙炔的结构式为H—C≡C—H,则乙炔中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,不存在π键
-
下列有关物质的表达式不正确的是
A.醛基的结构简式:—CHO
B.溴乙烷的电子式:
C.乙炔分子的结构式:H-C≡C-H
D.乙醇的分子式:C2H6O
-
I.下列是中学化学中熟悉的物质,请用序号完成下列问题
①O2②Na2O2③NH4Cl ④HCl ⑤NaOH ⑥CaCl2⑦氦气
(1)这些物质中,只含共价键的是__________________。只含离子键的是__________________。既含共价键又含离子键的是__________________。
(2)属于离子化合物的是_____________。
II.(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是__________(填“吸热”或“放热”)反应,NO2和CO的总能量____________(填“大于”、“小于”或“等于”)CO2和NO的总能量。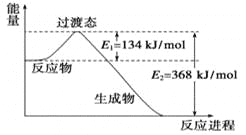
(2)已知拆开1molH﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151kJ、299kJ.则由氢气和碘反应生成1mol HI需要_____________(填“放出”或“吸收”)_____________kJ的热量.
-
下列物质中不含非极性共价键的是
①Na2O2 ②CCl4 ③C2H6 ④NH4Cl ⑤H2O2 ⑥Ca(OH)2
①②③④ B.④⑤⑥ C.②④⑥ D.②③⑤
CH3OH(g) ΔH1
CH3OH(g) +H2O(g) ΔH2
