-
下列推理正确的是
A. 铝粉在氧气中燃烧生成Al2O3,故铁丝在氧气中燃烧生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,故钠也能从硫酸铜溶液中置换出铜
C. 活泼金属钠保存在煤油中,故活泼金属铝也保存在煤油中
D. 钠与氧气、水等反应时钠均作还原剂,故金属单质参与反应时金属均作还原剂
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是 ( )
A. 标准状况下,11.2 L H2O 含有的氢原子数是NA
B. 24 g Mg中含有的电子数是2 NA
C. 0.5 mol·L-1K2SO4溶液中含有的钾离子数是NA
D. 常温常压下,3.2 g氧气所含的分子数是0.1 NA
难度: 简单查看答案及解析
-
化学与环境、材料、信息、能源关系密切,下列说法错误的是( )
A. 低碳生活注重节能减排,减少温室气体的排放
B. 推广使用可降解塑料及布质购物袋,以减少“白色污染”
C. 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
D. 启用大气中细颗粒物(PM2.5)的监测,以追根溯源,采取措施,改善空气质量
难度: 简单查看答案及解析
-
下列有关化学用语的表示正确的是 ( )
A. Ca(OH)2的电离方程式:Ca(OH)2=Ca2++(OH‑)2
B. Al3+的结构示意图:
C. 明矾的化学式:KAl(SO4)2
D. NaClO中氯的化合价:-1
难度: 中等查看答案及解析
-
下列实验室常见物质的俗名与化学式相对应的是( )
A. 苏打-NaHCO3 B. 胆矾-CuSO4
C. 烧碱-NaOH D. 生石灰-Ca(OH)2
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 0.1mol•L﹣1 AlCl3溶液中:H+、Na+、Cl﹣、SO42﹣
B. 含有0.1mol•L﹣1 Fe3+的溶液中:Na+、K+、SCN﹣、NO3﹣
C. 能在溶液中大量共存且溶液为无色透明的是:K+、Mg2+、NO3-、OH-
D. 能在溶液中大量共存且溶液为无色透明的是:Cu2+、K+、NO3-、SO42-
难度: 困难查看答案及解析
-
下列有关物质用途的说法错误的是( )
A. 明矾可用于净水 B. Fe2O3可用于制红色油漆
C. 纯碱溶液可用于去除油污 D. 硅可用于制光导纤维
难度: 中等查看答案及解析
-
下列物质属于纯净物的是( )
A. 氯水 B. 漂白粉 C. 液氯 D. 石油
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 向FeCl3溶液中滴加HI溶液:Fe3++2I-===Fe2++I2
B. 向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
C. Al2O3溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O
D. 碳酸镁溶于盐酸:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
下列物质属于电解质的是 ( )
A. 熔融NaCl B. 稀硫酸 C. CO2 D. 铜
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验,能达到实验目的的是( )
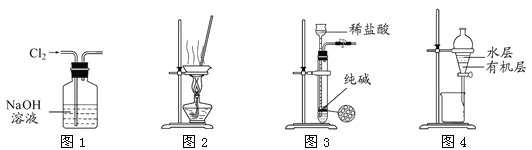
A. 用图1 所示装置除去Cl2中含有的少量HCl
B. 用图2 所示装置蒸干NaHCO3饱和溶液制备NaHCO3晶体
C. 用图3 所示装置制取少量纯净的CO2气体
D. 用图4 所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
下列离子的检验方法合理的是( )
A. 向某溶液中加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,则该溶液中一定有SO42-
B. 向某溶液中滴加氯水,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C. 向某溶液中加入NaOH溶液,得红褐色沉淀,说明溶液中含有Fe3+
D. 向某溶液中加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32-
难度: 中等查看答案及解析
-
下列过程涉及化学变化的是 ( )
A. 酒香扑鼻 B. 干冰升华
C. 蜡烛照明 D. 用金刚石切割玻璃
难度: 中等查看答案及解析
-
下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号
物质转化关系
a
b
c
d
①
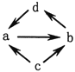
Na2O
Na2O2
Na
NaOH
②
Al2O3
NaAlO2
Al
Al(OH)3
③
FeCl2
FeCl3
Fe
CuCl2
④
Si
SiO2
Na2SiO3
H2SiO3
A. ①② B. ②③ C. ②④ D. ①③
难度: 中等查看答案及解析
-
下列溶液中,与100 mL 0.5 mol/L NaCl溶液所含的Cl- 物质的量浓度相同的是( )
A. 100 ml 0.5 mol/L MgCl2溶液 B. 200 ml 0.25 mol/L AlCl3溶液
C. 50 ml 1 mol/L NaCl溶液 D. 25 ml 0.5 mol/L HCl溶液
难度: 简单查看答案及解析
-
下列实验操作、现象和结论均正确的是 ( )
实验操作
现象
结论
A
将气体通入灼热的CuO固体
固体由黑色变为红色
该气体一定为CO
B
向某溶液中加入1~2滴KSCN溶液
生成血红色沉淀
该溶液中含Fe3+
C
向Al(OH)3中加入HCl或NaOH溶液
固体均溶解
Al(OH)3是两性氢氧化物
D
将氯气通入装有潮湿的有色布条的试剂瓶中
有色布条颜色褪去
Cl2具有漂白性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示。下列说法错误的是( )
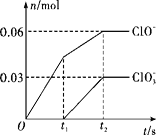
A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.42NA
C. 原苛性钾溶液中KOH的物质的量为0.3 mol
D. 生成物中Cl-的物质的量为0.21 mol
难度: 中等查看答案及解析