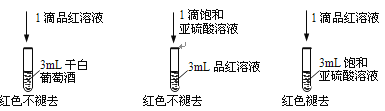
-
下列有关说法不正确的是
A. 纤维素、蛋白质和油脂都是能发生水解反应的高分子化合物
B. “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关
C. 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果
D. 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应
难度: 中等查看答案及解析
-
分类法是一种行之有效、简单易行的科学方法,某同学用如表所示的形式对所学知识进行分类,其中甲与乙、丙、丁、戊是包含关系。正确的有( )个
选项
甲
乙、 丙、 丁、 戊
①
弱电解质
次氯酸、一水合氨、水、醋酸
②
碱性氧化物
过氧化钠、氧化镁、氧化铝、氧化铁
③
基本营养物质
油脂、蛋白质、纤维素、无机盐
④
腐蚀品
盐酸、浓硫酸、烧碱、硝酸
⑤
常见合金
不锈钢、青铜、硬铝、生铁
⑥
常见干燥剂
浓硫酸、石灰石、碱石灰、五氧化二磷
A. 2 B. 3 C. 4 D. 5
难度: 中等查看答案及解析
-
有关阿伏伽德罗常数NA的叙述正确的是
A. 标准状况下,2.24 L HF含有的HF分子数为0.1NA
B. 标准状况下,1.12 L 1H2和0.2 g 2H2均含有0.1NA个质子
C. 等体积、等物质的量浓度的NaCl和KF溶液中,阴、阳离子数目之和相等
D. 将0.1 mol Cl2通入足量水中,充分反应后,转移电子的个数为0.1NA
难度: 中等查看答案及解析
-
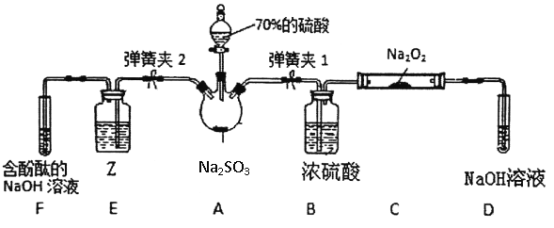
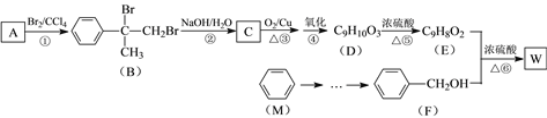
我国对可呼吸的钠——二氧化碳电池的研究取得突破性进展,该电池的总反应式为:4Na+3CO2
2Na2CO3+C,其工作原理如图所示(放电时产生的碳酸钠固体储存于碳纳米管中)。关于该电池,下列说法错误的是
A. 放电时,当转移1 mol电子时负极质量减轻23 g
B. 充电时,Na+从阳极向阴极移动
C. 放电时,正极反应式为3CO2+4Na++4e-=2Na2CO3+C
D. 可以用乙醇代替TEGDME作有机溶剂
难度: 中等查看答案及解析
-
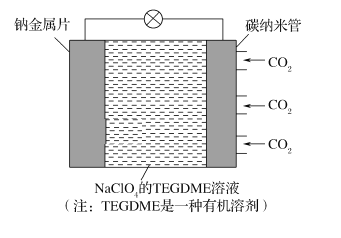
短周期元素A、B、C、D、E、F的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,A和D同主族,B和C相邻,F的最高价氧化物对应的水化物为无机含氧酸中的最强酸。E与B可组成化合物E3B2,且该物质遇水发生水解反应。已知利用如下图所示装置以制备E3B2,装置①用于制备B单质。
下列说法正确的是
A. E与B的简单离子的电子层结构相同,且简单离子半径B<E
B. ④⑥中依次盛装的试剂可以是NaOH溶液、碱石灰
C. D元素形成的单质与A2C不反应
D. 实验结束后,取⑤中的少量产物于试管中,加适量蒸馏水,可以产生使试管口湿润的红色石蕊试纸变蓝的气体
难度: 中等查看答案及解析
-
有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为
,有机物X的键线式为
。下列关于有机物X的说法中正确的是
A. X的含氧官能团是酯基和羟基
B. 有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含苯环,则Y的结构有8种
C. 1molX与足量Na完全反应生成11.2LH2
D. X的分子式为C7H6O3
难度: 中等查看答案及解析
-
常温下用0.10 mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol • L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线。下列说法正确的是

A. 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN
B. 点③和点⑤所示溶液中:c(CN—) = c(CH3COO—)
C. 点①和点②所示溶液中 c(CH3COO—)-c(CN—) =c(HCN)-c(CH3COOH)
D. 在点②和③之间(不包括端点)存在以下关系:c(Na+)>c(A—)>c(H+)>c(OH—)(A—代表溶液中的酸根离子)
难度: 困难查看答案及解析