-
现有室温下四种溶液,有关叙述不正确的是( )
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH ①>②>④>③
D. V1 L ④与V2 L ①混合,若混合后溶液pH=7,则V1< V2
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是( )
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. 无色溶液中:Cu2+、Al3+、NH4+、Cl-
C. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D. 0.1mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 浓度为0.1 mol·L-1 CH3COOH溶液,加水稀释,则c(CH3COO-)/c(CH3COOH)减小
B. 浓度为0.1 mol·L-1 CH3COOH溶液,升高温度,Ka(CH3COOH)不变,但醋酸的电离程度增大
C. 浓度为0.1 mol·L-1 HA溶液pH为4,则HA为弱电解质
D. CH3COOH的浓度越大,CH3COOH的电离程度越大
难度: 中等查看答案及解析
-
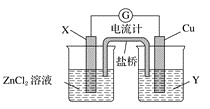
下列叙述正确的是( )
A. 电解质溶液导电是化学变化,金属导电是物理变化
B. 某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
C. 因为镁的活泼性强于铝,所以将镁、铝用导线连接后放入氢氧化钠溶液中,镁作负极、铝作正极
D. 不能自发进行的氧化还原反应,任何方法都不可以实现
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 一般来说,不纯的金属与电解质溶液接触时,会发生原电池反应
B. 溶液中Fe2+ 可以用K3[Fe(CN)6]溶液来检测
C. 铁锈覆盖在钢铁表面,阻止钢铁继续腐蚀
D. 在船身上装锌块来避免船体遭受腐蚀
难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是( )
A. NaOH B. Na2CO3 C. NH3·H2O D. MgCO3
难度: 中等查看答案及解析
-
25℃时,浓度均为0.10 mol/L 的NaHCO3 和Na2CO3 溶液中,下列判断不正确的是( )
A. 两种溶液中存在的粒子种类相同 B. 两种溶液中均存在电离平衡和水解平衡
C. c(OH-)前者大于后者 D. 分别加入NaOH固体,恢复到原温度,c(CO32-)均增大
难度: 中等查看答案及解析
-
关于化学反应进行的方向叙述不正确的是( )
A. △H<0,△S>0时,反应自发进行,如金属钠和水的反应
B. 过程的自发性能判断过程的方向,还能确定过程是否一定会发生
C. △H>0,△S<0时,反应不自发进行,如2CO(g)=2C(s)+O2(g)
D. 同一种物质,气态时的熵值最大、液态时次之、固态时最小
难度: 中等查看答案及解析
-
25℃时,下列溶液的离子浓度关系式正确的是( )
A. pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1
B. 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>②
C. 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl﹣)>c(H+)>c(OH﹣)
D. 将amol·L﹣1CH3COOH与bmol·L﹣1NaOH溶液等体积混合,测得溶液pH为7,则a>b
难度: 困难查看答案及解析
-
下列判断中,正确的是( )
A. 已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 25 ℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小
C. pH试纸测得新制氯水的pH为4
D. FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3
难度: 中等查看答案及解析
-
下列盐类水解的应用,不正确的是
A. 实验室配制氯化铁溶液时,滴入少量稀硫酸抑制水解
B. 为使纯碱溶液的去油污效果更好,可以使用热的纯碱溶液
C. 明矾可用于净水,是由于溶于水后产生的Al(OH)3胶体具有吸附作用
D. 铵态氮肥不能和草木灰混合施用,是由于NH4+与CO32﹣互相促进水解,肥效下降
难度: 中等查看答案及解析
-
下列关于能量的说法或做法不合理的是( )
A. 升高温度或加入催化剂,均不可以改变化学反应的反应热
B. 太阳能电池将化学能转化为电能
C. 电镀将电能转化为化学能
D. 物质发生化学变化,一定伴随着能量变化
难度: 简单查看答案及解析
-
下列化学方程式中,属于水解反应的是( )
A. H2O+H2O
H3O++OH-
B. HS-+OH-
H2O+S2-
C. HS-+H2O
H3O++S2-
D. HS-+H2O
H2S+OH-
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 改变物质表面积可以改变化学反应速率
B. 催化剂同时改变正逆反应速率
C. 活化分子的每次碰撞都能发生反应
D. 活化能的作用在于使反应物活化,从而启动反应或改变反应速率
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下反应:2X(g)+Y(g)
Z(g)+W(s)ΔH>0,下列叙述正确的是( )
A. 在容器中加入氩气,反应速率不变
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
难度: 中等查看答案及解析
-
在恒温、容积不变的密闭容器中进行如下反应:N2(g)+3H2(g)
2NH3(g),达到平衡。下列说法不正确的是( )
A. 其它条件不变,缩小容器体积,平衡正向移动,K值变大
B. 其它条件不变,通入少量氦气,平衡不移动
C. N2、H2、NH3百分含量不再变化
D. 其它条件不变,升高温度,化学平衡一定发生移动
难度: 中等查看答案及解析
-
容积不变的密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列对于图像分析正确的是( )
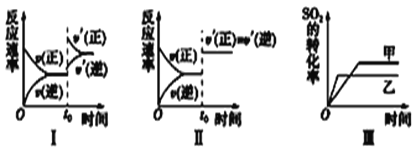
A. 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响
B. 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响
C. 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D. 图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. pH=7的溶液一定显中性
B. pH=6的溶液一定显酸性
C. c(H+)<c(OH-)的溶液一定显碱性
D. c(OH-)=1×10-6 mol/L的溶液一定显酸性
难度: 中等查看答案及解析
-
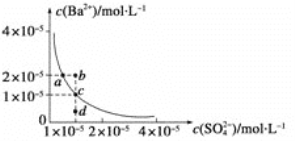
下列叙述正确的是 ( )
A. 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
B. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D. CaCO3 难溶于稀硫酸,但可溶于醋酸
难度: 中等查看答案及解析
-
用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A. 滴定前酸式滴定管需用盐酸标准液润洗
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
难度: 中等查看答案及解析
-
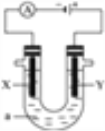
研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )
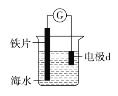
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+2H2O+4e-=4OH-
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++2e-=H2↑
难度: 中等查看答案及解析
-
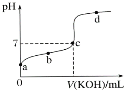
室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元
酸HA,溶液pH的变化曲线如图所示。下列说法正确的是
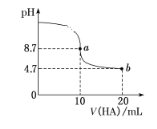
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. a、b两点所示溶液中水的电离程度相同
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. b点所示溶液中c(A-)>c(HA)
难度: 简单查看答案及解析
-
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示,下列有关描述正确的是( )
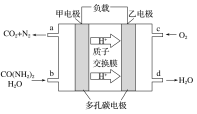
A. 电池工作时H+移向负极
B. 该电池用的电解质溶液是KOH溶液
C. 甲电极反应式:CO(NH2)2+H2O-6e-=CO2+N2+6H+
D. 电池工作时,理论上每净化1 mol CO(NH2)2,消耗33.6 L O2
难度: 中等查看答案及解析
-
电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )
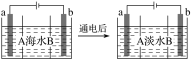
A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
难度: 困难查看答案及解析