-
俄罗斯杜布纳核联合研究所和美国劳伦斯利弗莫尔国家实验室的科学家在2004年2月的美国《物理评论C》杂志上发表文章宣布, 他们新合成了元素周期表上的第115号和第113号元素。科学家在利用回旋加速器进行的实验中,用具有20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为
。下列有关叙述正确的是
A.115号元素衰变成113号元素是化学变化
B.核素
中中子数与质子数之差为174
C.113号元素最高正价应为+3
D.115号与113号元素的原子质量比为115∶113
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.原子晶体中原子间平均距离越小,熔、沸点越高
B.在水溶液中能电离出自由移动的离子的晶体不一定是离子晶体
C.SnH4 、GeH4、SiH4、CH4四种物质的熔点依次降低
D.水加热到很高的温度都难以分解,是因为水分子之间存在着氢键
难度: 简单查看答案及解析
-
同温同压下,下列各组热化学方程式中,△H1<△H2是
A.S(g)+O2(g)=SO2(g); △H1 S(s)+O2(g)=SO2(g); △H2
B.1/2H2(g)+1/2Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
D.C(s)+1/2O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
难度: 简单查看答案及解析
-
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
,b与c形成化合物的电子式
为下列比较中正确的是
A.原子半径:a>c>d>b b B.原子的氧化性a>b>d>c
C.原子序数:a>d>b>c D.最高价含氧酸的酸性c>d>a
难度: 简单查看答案及解析
-
下列实验操作中,所使用的有关仪器要求干燥的是
A.中和滴定实验中所用的锥形瓶 B.喷泉实验中收集氯化氢气体的圆底烧瓶
C.配制一定物质的量浓度溶液时所用的容量瓶 D.制取CO时用于收集CO的集气瓶
难度: 简单查看答案及解析
-
向等体积pH均为1的盐酸和醋酸溶液中分别滴加等物质的量浓度的氢氧化钠溶液,当最后得到的两溶液pH相等时,盐酸中用去氢氧化钠溶液的体积为Vl,醋酸中用去氢氧化钠溶液的体积为V2。则Vl和V2的关系正确的是
A.Vl==V2 B.Vl>V2 C.Vl<V2 D.Vl≤V2
难度: 简单查看答案及解析
-
某同学设计实验证明NaOH溶液能使酚酞试液变红是OH-的性质,其中没有意义的是
A.取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色
B.取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
C.向滴有酚酞的NaOH溶液中,逐滴加盐酸,观察溶液颜色的变化
D.向滴有酚酞的盐酸中,逐滴加NaOH溶液,观察溶液颜色的变化
难度: 简单查看答案及解析
-
在铜催化作用下氨气和氟气反应.得到一种三角锥形分子M和一种盐N.下列有关说法正确的是
A.该反应中氨气和氟气的化学计量数之比为4∶3 B.该反应的还原产物是M
C.M是极性分子,其还原性比NH3强 D.N中只有一种化学键
难度: 简单查看答案及解析
-
铁氧体(Fe3O4)法是处理含铬废水的常用方法。其原理是用FeSO4把废水中Cr2O72-离子还原为Cr3+离子,并通过调节废水pH,使生成物组成符合类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物
·
。若处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O,则
A.x=1,y=4,z=6 B.x=0.5,y=1.5,z=8.5
C.x=2,y=4,z=6 D.x=2,y=6,z=4
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.CO2分子内含有极性键,所以CO2分子是极性分子
B.分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键
C.气态氢化物的稳定性:NH3>PH3>AsH3
D.某非金属元素从游离态变成化合态时,该元素一定被还原
难度: 简单查看答案及解析
-
在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是
A.36% B.54.5% C.40% D.33.3%
难度: 简单查看答案及解析
-
下列各组中,两种气体的分子数一定相等的是
A.质量相等,密度不等的C2H4和N2 B.温度相同,体积相同的O2和N2
C.压强相同,体积相同的O2和N2 D.体积不等,密度相等的CO和C2H4
难度: 简单查看答案及解析
-
下列叙述正确的是 ①氯气的性质很活泼,它与氢气混合后立即发生爆炸 ②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 ③新制氯水的氧化性强于久置氯水 ④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
难度: 简单查看答案及解析
-
下列每组物质发生状态变化所克服的粒子间的相互作用属于同类型的是
A.食盐和蔗糖熔化 B.钠和硫熔化 C.碘和干冰升华 D.二氧化硅和氧化钠熔化
难度: 简单查看答案及解析
-
2002年诺贝尔化学奖表彰了两项成果,其中一项是瑞士科学家库尔特·维特里希“发明了利用核磁共振技术测定溶液中生物大分子三维结构的方法”。在化学上经常使用的是氢核磁共振谱,它是根据不同化学环境的氢原子在氢核磁共振谱中给出的信号不同来确定有机物分子中氢原子种类的。下列有机物分子中,在氢核磁共振谱中信号强度(个数比)是1:3的是
A.1,2,3,—三甲基苯 B.丙烷 C.异丙醇 D.醋酸正丙酯
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC2—、dD—都具有相同的电子层结构,则下列叙述正确的是
A.原子半径A>B>D>C B.原子序数d>c>b>a
C.离子半径C>D>B>A D.单质的还原性B>A>D>C
难度: 简单查看答案及解析
-
在酸性溶液中能大量共存,并且溶液为无色透明的离子组是
A.NH
、Al3+、SO
、NO
B.K+、Na+、CO
、NO
C.K+、NH
、MnO
、SO
D.Na+、K+、NO
、HSO
难度: 简单查看答案及解析
-
下列性质的比较中,正确的是
A.熔点:Li<Na<K<Rb
B.沸点:NH3<PH3<AsH3<SbH3
C.热稳定性:SiH4>PH3>H2O>HF
D.酸性:H2SO3>H3PO4>HF>H2CO3>H2S>HClO
难度: 简单查看答案及解析
-
氯化碘(ICl)跟 水发生反应:ICl+H2O=HIO+HCl,这个过程可以称为ICl的水解。预计PCl3水解的产物是
A.PH3和HClO B.HCl和H3PO4 C.HCl和H3PO3 D.HCl和HPO3
难度: 简单查看答案及解析
-
A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A.原子序数:A>B>C>D B.单质熔点:D>B,A>C
C.原子半径:D>B>C>A D.简单离子半径:D>B>C>A
难度: 简单查看答案及解析
-
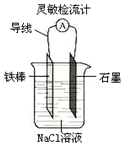
郑老师做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成有少量KSCN和FeCl2溶液,溶液显红色。判断下列说法中正确的是
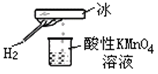
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有还原性
C.该条件下H2燃烧生成了具有氧化性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
难度: 简单查看答案及解析
-
Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x的值是
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况)。在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为
A.9.02g B.8.26g C.8.61g D.7.04g
难度: 简单查看答案及解析