-
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 空气、硫酸铜、硫酸 B. 醋酸、液氯、纯碱
C. 硝酸、食盐水、烧碱 D. 氧化铁、胆矾、熟石灰
难度: 简单查看答案及解析
-
下列实验操作中,错误的是
A. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶的支管口处
B. 蒸发时,应使混合物中的水分完全蒸干后,才能停止加热
C. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取时,应选择与原溶剂互不相溶的萃取剂
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,则下列说法不正确的是
A. 标准状况下,18gH2O所含电子数为10NA
B. 22.4L CO2与17 g NH3所含分子数相等
C. 0.9g铝与足量的盐酸反应,失去的电子数为0.1NA
D. 常温下,1L 0.1mol/L NaCl溶液中含Na+ 数为0.1NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑
B. 钠与水的反应:Na+2H2O=Na++2OH-+H2↑
C. 铜片跟稀硝酸的反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
D. 将氯气通入氯化亚铁溶液:2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Al3+、Fe2+、Cl-、SO42- B. NH4+、HCO3-、Cl-、K+
C. Na+、Ba2+、NO3-、SO42- D. Cl -、Na+、NO3-、Ca2+
难度: 中等查看答案及解析
-
下列关于天然物质水解的叙述正确的是
A. 油脂的水解反应都是皂化反应 B. 蛋白质水解的最终产物均为葡萄糖
C. 油脂的水解可得到甘油 D. 淀粉水解和纤维素水解得到的最终产物不同
难度: 简单查看答案及解析
-
下列各种方法中,最适用于炼制相应金属的是
A. 加热氧化铜制铜 B. 氧化铁与铝粉反应制铁
C. 电解熔融氯化铝制铝 D. 电解熔融氧化镁制镁
难度: 中等查看答案及解析
-
下列关于元素性质的有关叙述中不正确的是
A. C、N、O、F的原子半径依次减小
B. KOH、NaOH、LiOH的碱性逐渐减弱
C. P、S、Cl、Ar的最高正价依次升高
D. Na、Mg、Al、Si的最外层电子数依次增加
难度: 中等查看答案及解析
-
下列关于甲烷、乙烯、苯三种烃的比较中,正确的是( )
A. 只有甲烷不能因化学反应而使酸性高锰酸钾溶液褪色
B. 在空气中分别完全燃烧等质量的这三种烃,苯消耗的氧气最多
C. 除甲烷外,其余两种分子内所有原子都共平面
D. 甲烷和苯属于饱和烃,乙烯属于不饱和烃
难度: 中等查看答案及解析
-
下列说法正确的是
A. 共价化合物中一定不含离子键
B. 离子化合物中一定不含共价键
C. 任何化学物质中均存在化学键
D. 全部由非金属元素形成的化合物一定是共价化合物
难度: 中等查看答案及解析
-
下列叙述中正确的是
①电解池是将化学能转变为电能的装置
②原电池是将电能转变成化学能的装置
③不能自发进行的氧化还原反应,通过电解的原理有可能实现
④电镀过程相当于金属的“迁移”,可视为物理变化
A. ③ B. ③④ C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
温度相同,浓度均为0.2 mol/L的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是
A. ①③⑤④② B. ③①④②⑤ C. ⑤②④①③ D. ③②①⑤④
难度: 困难查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是
A. 某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B. pH= 4.5的番茄汁中c(H+)是pH= 6.5的牛奶中c(H+)的100倍
C. AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D. pH= 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 ( )
A.钢铁发生电化学腐蚀的正极反应式:Fe -2e- == Fe2+
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- == Cu2+
D.电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
难度: 极难查看答案及解析
-
根据以下三个热化学方程式:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)ΔH=Q1kJ/mol;2H2S(g)+O2(g)=2S(s)+2H2O(l) ΔH=Q2 kJ/mol;2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=Q3 kJ/mol。判断Q1、Q2、Q3三者关系正确的是
A. Q3>Q2>Q1 B. Q2>Q1>Q3 C. Q1>Q3>Q2 D. Q1>Q2>Q3
难度: 中等查看答案及解析
-
在密闭容器中一定量混合气体发生反应:x A(g)+y B(g)
z C(g)平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为0.2 mol/L,下列判断正确的是
A. 平衡向逆反应方向移动 B. x+y<z
C. C的体积分数保持不变 D. B的转化率降低
难度: 中等查看答案及解析

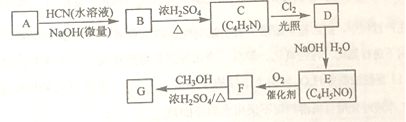
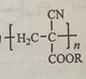 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下: