-
已知: ① CH3OH(g) + 3/2O2(g) = CO2(g) + 2H2O(g) △H= -a kJ•mol-1
② CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H= -b kJ•mol-1
③ CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) △H= -c kJ•mol-1
则下列叙述正确的是
A. 由上述热化学方程式可知b>c
B. 甲烷的燃烧热为b kJ•mol-1
C. 2CH3OH(g) = 2CH4(g) + O2(g) △H= 2(b-a) kJ•mol-1
D. 当甲醇和甲烷物质的量之比为1: 2,完全燃烧生成CO2(g)和H2O(l)时,放出的热量为Q kJ,则该混合物中甲醇的物质的量为Q/(a+2b)mol
难度: 中等查看答案及解析
-
下列过程没有发生化学变化的是
A. 用热碱水清除炊具上残留的油污
B. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C. 用鸡蛋壳内膜和蒸馏水除去淀粉胶体中的少量氯化钠
D. 用含硅胶、铁粉的透气小袋与食品一起密封包装
难度: 简单查看答案及解析
-
用类推法可能会得出错误的结论,因此推出的结论要经过实践的检验才能确定其正确与否。下列推论中正确的是
A. 加热条件下,Na与氧气反应生成过氧化钠,锂与氧气反应生成过氧化锂
B. 相同温度下,Ca(HCO3)2的溶解度大于CaCO3,NaHCO3的溶解度大于Na2CO3
C. Al3+与S2-在溶液中可发生相互促进的水解反应生成沉淀和气体,Fe3+与S2-也如此
D. 可以用铝制或铁制容器常温下贮运浓硫酸,也可贮运浓硝酸
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A.
向20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液,未出现银镜
蔗糖未水解
B.
对某白色固体进行焰色反应,火焰呈紫色
该固体为钾盐
C.
向FeBr2溶液中加入少量氯水再加CCl4,CCl4层呈无色
Fe2+的还原性强于Br-
D.
将溴乙烷与NaOH乙醇溶液共热产生的气体通入酸性KMnO4溶液中,溶液褪色
产生的气体为乙烯
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24 LCH3OH中含有的原子数目为6 NA
B. 18 g 2H2O中含有的电子数目为10 NA
C. 25℃时,1 L pH=13的Ba(OH)2溶液中含有OH-数为0.05 NA
D. 常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5 NA
难度: 中等查看答案及解析
-
某种合成药物中间体X的结构简式如图所示。下列说法正确的是
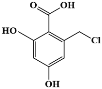
A. X的分子式为C8H8O4Cl
B. 1 mol X与足量浓溴水反应,最多消耗2 mol Br2
C. 一定条件下,X分子能发生加成、取代、消去、加聚反应
D. 1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH
难度: 中等查看答案及解析
-
下列说法正确的是
A. 将苯加入溴水中振荡后,水层接近无色,是因为发生了取代反应
B. 2,2-二甲基丙烷也称新戊烷
C. 等质量的乙烯和乙醇在氧气中充分燃烧耗氧量相同
D. 环己醇能与氢氧化钠溶液反应且所有碳原子可以共面
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Y的氢化物为具有臭鸡蛋气味的气体,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与其他三种元素均可形成至少两种二元化合物
C. 气态氢化物的热稳定性:W<Y
D. 氧化物对应水化物的酸性:Y<Z
难度: 中等查看答案及解析
-
对可逆反应4NH3(g) + 5O2(g)
4NO(g) + 6H2O(g),下列叙述正确的是
A.达到化学平衡时,5v正(O2)=4v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大
D.达到平衡前,化学反应速率关系:3v正(NH3)=2v正(H2O)
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. c(H+)/c(OH-) = 1×10-12的溶液中:K+、Na+、CO32-、NO3-
B. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
C. 室温下,由水电离的c(H+)=10-10 mol·L-1的溶液中:Cl-、HCO3-、NO3-、NH4+
D. 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列关于反应热和热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则CH3COOH和NaOH反应的中和热ΔH=-57.3 kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO(g)+O2(g)===2CO2(g)的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)
2H2(g)+O2(g) ΔH=+2×285.5 kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
难度: 中等查看答案及解析
-
H2S与CO2在高温下发生反应:CO2 (g) + H2S (g)
COS (g) + H2O (g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。下列说法不正确的是
A. 升高温度,H2S浓度增加,表明该反应是放热反应
B. 通入CO2后,正反应速率先增大后减小
C. H2S的平衡转化率α = 4.5 %
D. 反应平衡常数K = 2.8×10-3
难度: 困难查看答案及解析
-
某次酸雨的分析数据如下:c(NH4+)=2.0×10-5 mol/L,c(Na+)=1.9×10-5 mol/L,c(Cl-)=6.0×10-5 mol/L,c(NO3-)=2.3×10-5 mol/L,c(SO42-)=2.8×10-5 mol/L,则此次酸雨的pH大约为
A. 3 B. 4 C. 5 D. 6
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 25℃时,若某溶液中c(H+)=c(OH-)=10-7 mol/L,则该溶液呈中性
B. 溶液中若c(H+)>10-7 mol/L,则c(H+)>c(OH-),溶液显酸性
C. c(H+)越大,则pH值越大,溶液的酸性越强
D. pH值为0的溶液中c(H+) = 0 mol/L
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下pH为2的盐酸与等体积pH=12的氨水混合后所得溶液显酸性
B. 中和等体积、等物质的量的浓度的盐酸和醋酸,盐酸消耗的n(NaOH)大
C. 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
D. CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(CH3COO-)的值减小
难度: 中等查看答案及解析
-
已知某可逆反应aA(g)+bB(g)
cC(g) ΔH,在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断中正确的是
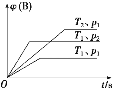
A. p1<p2,T1>T2,a+b<c,ΔH>0
B. p1<p2,T1>T2,a+b>c,ΔH>0
C. p1>p2,T1<T2,a+b<c,ΔH<0
D. p1>p2,T1<T2,a+b>c,ΔH<0
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 自发反应在任何条件下都能实现
B. 化学反应不一定都有能量变化
C. 升高温度,活化分子百分数增大,化学反应速率一定增大
D. 一般使用催化剂可以降低反应的活化能,增大活化分子百分数,从而提高反应物的转化率
难度: 简单查看答案及解析
-
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入明矾晶体 ⑤向水中加NaHCO3固体 ⑥向水中加NaHSO4固体 ⑦向水中加NH4Cl固体
A. ①②④⑤ B. ①⑤⑦ C. ③④⑥ D. ④⑦
难度: 中等查看答案及解析
-
室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
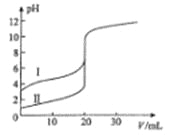
A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
难度: 困难查看答案及解析
-
已知:常温下浓度均为0.1 mol/L的下列溶液的pH如下表:
溶质
NaF
Na2CO3
NaClO
NaHCO3
pH
7.5
11.6
9.7
8.3
下列有关说法正确的是
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N(NaClO)<N(NaF)
C. 向0.1 mol/L Na2CO3溶液中通入CO2至中性,则溶液中:2c(CO32-) + c(HCO3-) = 0.1 mol/L
D. 向Na2CO3溶液中通入少量的HF气体,发生反应的化学方程式为:Na2CO3 + 2HF = CO2 + H2O + 2NaF
难度: 困难查看答案及解析
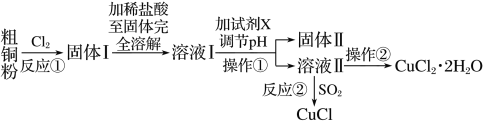
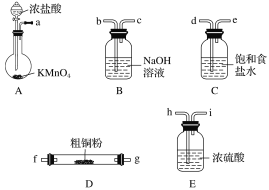
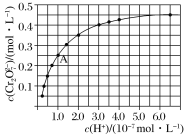
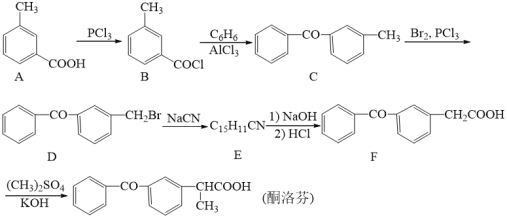
 的合成路线流程图(无机试剂可任选)________________。
的合成路线流程图(无机试剂可任选)________________。