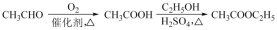-
下列我国科技创新的产品设备在工作时有化学能转变成电能的是

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列物质与常用危险化学品的类别不对应的是
A. 浓H2SO4——腐蚀品 B. 甲烷——易燃液体
C. KMnO4——氧化剂 D. Na——遇湿易燃物品
难度: 中等查看答案及解析
-
2016年IUPAC将合成化学元素第115号(Mc)提名为化学新元素,Mc的原子核最外层电子数是5,下列说法不正确的
A. Mc位于第七周期 B. Mc与N元素属于同一主族
C. Mc的同位素原子具有相同的电子数 D. 中子数为173的Mc核素符号是173115Mc
难度: 简单查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述不正确的
A. 葡萄糖不具有还原性 B. 淀粉是多糖,可在一定条件下水解
C. 油脂属于酯类化合物 D. 蛋白质最终能水解成氨基酸
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温常压下,11.2 L CO2物质的量为0.5 mol
B. 常温下,3.6 g水约含0.2NA个水分子
C. 标准状况下,2.24L NH3含有的氢原子总数为6.02×1023
D. 100 mL 0.1 mol/LNa2CO3溶液中含有0.01mol Na+
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
常温下,0.1 mol/LCH3COOH溶液的pH大于1
乙酸是弱酸
B
向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀
该溶液中一定有SO42-
C
向饱和NaHCO3溶液中加入足量氯水,有无色气体产生
氯水中含HClO
D
Cl2、SO2均能使品红溶液褪色
两者均有氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学用语对事实的表述不正确的是
A. 用电子式表示H2O分子:
B. 乙烯与Br2加成:

C. 硝酸受热分解的化学方程式:2HNO3
2NO2↑+O2↑+H2O
D. 电解饱和食盐水的离子方程式:2Cl- +2H2O
2OH-+ H2↑+Cl2↑
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W原子序数依次增大,X原子的最外层有5个电子,Y是迄今发现的非金属性最强的元素,Z的原子半径是短周期元素原子中最大的,W与Y属于同一主族。下列说法不正确的是
A. Z和W两种元素组成的物质为离子化合物 B. 对应氢化物的稳定性:Y>X
C. 简单离子半径:Y>Z D. Z、X、Y对应的最高正价依次升高
难度: 中等查看答案及解析
-
格列卫是治疗白血病和多种癌症的一种抗癌药物,在其合成过程中的一种中间产物结构表示如下:
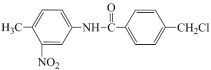
下列有关该中间产物的说法不正确的是
A. 分子中可以发生水解反应的官能团有两种
B. 碱性条件下水解的产物之一,含有官能团—NH2
C. 碱性条件下水解的产物之一,经酸化后自身可以发生缩聚反应
D. 水解产物的单个分子中,苯环上都有3种不同化学环境的氢原子
难度: 中等查看答案及解析
-
向2 L的恒容密闭容器中通入气体X和Y,发生反应X(g)+Y(g)
Z(g) ΔH,所得实验数据如下表:
实验
编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
达到平衡的时间/min
n(X)
n(Y)
n(Z)
①
400
4.0
3.0
2.0
2
②
500
4.0
3.0
1.0
1
③
500
4.0
1.0
下列说法不正确的是
A. 该反应正反应为放热反应
B. ①中,0-2min内,用Y表示的平均反应速率υ (Y)=1 mol/(L·min)
C. ③中,达到平衡时,该反应的平衡常数K=
D. ③中,达到平衡时,n(Z)<1.0 mol
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
A. 检验溴乙烷消去反应产物
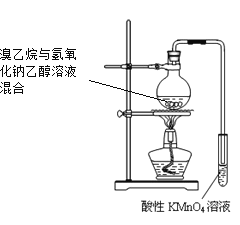
B. 证明Fe(OH)3比Mg(OH)2更难溶

C. 检验蔗糖的水解产物

D. 探究铁的析氢腐蚀
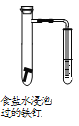
难度: 困难查看答案及解析
-
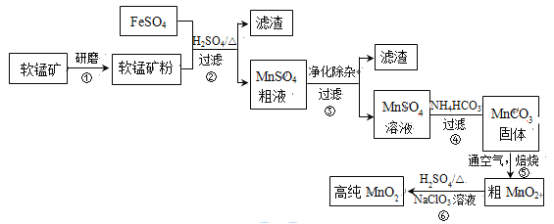
工业利用海水提镁的流程如下图所示。
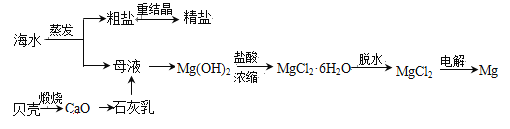
下列说法不正确的是
A. 海水蒸发的目的是富集
B. 石灰乳向Mg(OH)2转化说明Mg(OH)2的溶解度更小
C. MgCl2·6H2O加热脱水制MgCl2需在HCl气氛中,防止MgCl2水解
D. 电解熔融MgCl2时,阳极有金属Mg析出
难度: 中等查看答案及解析
-
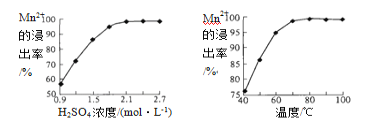
1,2-丙二醇脱氧脱水反应的催化循环机理如下图所示。

下列说法不正确的是
A. 产物CH2=CHCH3不存在顺反异构
B. 过程②中有O—H键发生断裂
C. 过程③④中均有C—C键发生断裂
D. 该反应方程式为:2CH2(OH)CH(OH)CH3
HCHO+CH3CHO+CH2=CHCH3+2H2O
难度: 中等查看答案及解析
-
为探讨化学平衡移动原理与氧化还原反应规律的联系,实验如下。
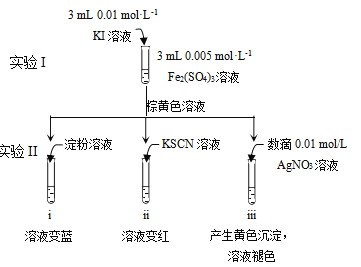
下列说法不正确的是
A. 试管i溶液变蓝证明有I2生成
B. 结合试管i、ii中现象,可知2Fe3++2I-
2Fe2++I2
C. 试管iii中溶液褪色说明I2转化为I-,此时I-还原性强于Fe2+
D. 对比实验I和试管iii中现象,说明物质的氧化性与还原性强弱受浓度影响
难度: 中等查看答案及解析
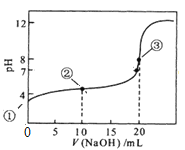

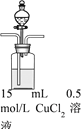
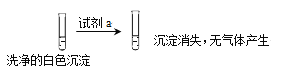
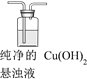
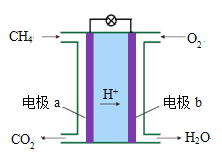
 )是良好的生物可降解材料,其合成路线如下:
)是良好的生物可降解材料,其合成路线如下: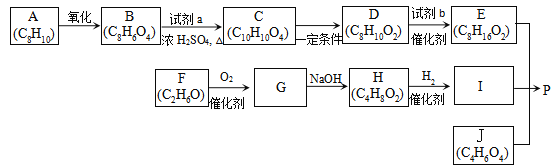
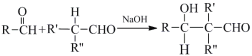 (R,R’,R’’代表烷基或H)
(R,R’,R’’代表烷基或H)