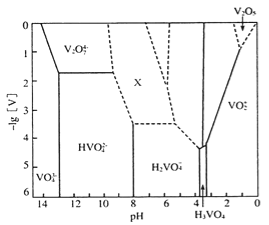
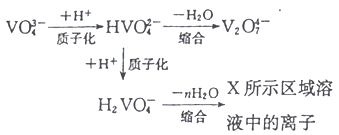
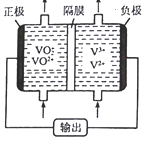
-
下列叙述中,不正确的是:
A. 热稳定性:Na2CO3 比 NaHCO3稳定
B. 溶解性:Na2CO3比 NaHCO3易溶于水(同一条件下)
C. 相同质量的Na2CO3 和 NaHCO3分别与足量的稀盐酸充分反应后,Na2CO3放出CO2多
D. 用FeCl3溶液腐蚀印刷电路板 Cu + 2Fe3+ == Cu2+ + 2Fe2+
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是
A. 在无色溶液中:Cu2+、Cl-、NO3- 、Ag+
B. 在含大量CO32-的溶液中:SO42-、K+、H+、S2-
C. 在强酸性溶液中:Na+、SO42-、Al3+、Mg2+
D. 在强碱性溶液中:SO32-、Ba2+、ClO-、Al3+
难度: 简单查看答案及解析
-
某500mL溶液中含0.1mol Fe2+,0.2mol Fe3+,加入0.2mol铁粉,待Fe3+完全还原后,溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)
A. 0.4mol/L B. 0.6mol/L C. 0.8 mol/L D. 1.0 mol/L
难度: 中等查看答案及解析
-
将一小块钠投入盛50mL澄清饱和石灰水的烧杯里,不可能观察到的现象是( )
A. 钠熔成小球并在液面上游动 B. 有气体生成
C. 溶液底部有银白色物质生成 D. 溶液变浑浊
难度: 简单查看答案及解析
-
化学与人类生产、生活密切相关,下列说法正确的是( )
A.人体缺乏铁元素,可以补充硫酸亚铁,且多多益善
B.古代镀金(鎏金)工艺,利用了电镀原理
C.反复煮沸的水含有较多的亚硝酸盐,对人体有害
D.护肤品中含有的甘油具有美白作用
难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应的是( )
A. SO2+2KOH=K2SO3+ H2O B. CaCO3
CaO+CO2↑
C. Na2CO3+CaCl2===CaCO3↓+2NaCl D. Fe+2FeCl3= 3FeCl2
难度: 中等查看答案及解析
-
有关氧化还原反应的下列叙述正确的是( )
A. 氧化剂发生还原反应,还原剂发生氧化反应
B. 氧化剂被氧化,还原剂被还原
C. 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D. 氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O
下列说法中,不正确的是 ( )
A. S2O32-是还原剂 B. Y的化学式为Fe2O3
C. a=4 D. 每有1molO2参加反应,转移的电子总数为4mol
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是
A. 称量NaOH 固体
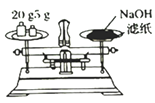
B. 配制100mL0.1mol/L 的H2SO4 溶液
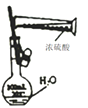
C. 家里的食用胡麻油不小心混入了大量的水采取的分离方法
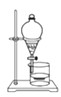
D. 提纯Fe(OH)3 胶体

难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
向盐酸酸化的Ba(NO3)2溶液中通入SO2
有白色沉淀生成
BaSO3难溶于酸
B
向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
C
向FeBr2溶液中加入少量氯水,再加CCl4萃取
CCl4层无色
Fe2+的还原性强于Br-
D
向亚硫酸钠溶液中滴加盐酸
有气体产生
非金属性Cl>S
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5NA
B.14g分子式为CnH2n的链烃中含有的C-H键的数目为2NA
C.室温时,1.0 L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.Fe与水蒸气反应生成22.4L氢气,转移电子数为2NA
难度: 简单查看答案及解析
-
常温常压下某CO2、H2、CO的混合气体与氮气的密度相同,则该混合气体中CO2、H2、CO的质量之比可能为( )
A. 13:8:27 B. 13:9:27 C. 26:16:27 D. 286:8:27
难度: 中等查看答案及解析
-
对于反应8NH3+3Cl2=N2+6NH4Cl,下列说法正确的是( )
A.N2是还原产物,且还原剂与氧化剂物质的量之比是2:3
B.N2是氧化产物,且还原剂与氧化剂物质的量之比是2:3
C.每转移6mol电子就生成22.4LN2
D.NH4Cl是氧化产物,且还原产物与氧化产物物质的量之比是1 : 6
难度: 困难查看答案及解析
-
一定条件下,下列物质可通过化合反应制得的共有( )
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤氢氧化铜 ⑥氢氧化铁
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
在含有Na+、Cl-、
离子的溶液中,能大量共存的离子是
A. K+ B. H+ C. Ca2+ D. Ag+
难度: 中等查看答案及解析
-
在同温同压下,A容器的H2和B容器的NH3,若所含氢原子数目之比为2:3,则这两个容器的体积比是
A.1:1 B.2:3 C.3:2 D.1:3
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 将1 molNH3通入水中得到1L溶液,则NH4+与NH3·H2O粒子总数为NA
B. 1.2 g NaHSO4晶体中含有离子总数为0.03 NA
C. 标准状况下,2.24 L SO3含有的分子数为0.1 NA
D. 14 g乙烯和环丙烷(C3H6)混合气体中的碳原子数为NA
难度: 中等查看答案及解析
-
将标准状况下的aLHCl (g) 溶于1000g水中,得到的盐酸密度为b g/cm3,则该盐酸的物质的量浓度是( )
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 中等查看答案及解析
-
体积为VmL,密度为d g·cm-3的溶液,含有相对分子质量为M的溶质m g,其物质的量浓度为c mol·L-1,质量分数为w%,下列表达式正确的是( )
A. c=(w×100×d)/M B. m=V×d×w
C. w=(c×M)/(1000×d) D. c=(1000×m)/(V×M)
难度: 中等查看答案及解析
-
F2和Xe在一定条件下生成氧化性极强且极易与水反应的XeF2、XeF4两种化合物(F的化合价为-1价)。其中XeF4与H2O可以发生如下反应:6 XeF4+12H2O=2XeO3+4Xe↑+24HF+3O2↑。下列判断正确的是( )
A. 上述反应中氧化剂是XeF4 ,还原剂只有H2O
B. XeF4按以上方式与水反应,每生成3molO2转移16mol电子
C. XeF2加入水中,在水分子的作用下,将发生分解反应生成Xe和F2
D. XeF2、XeF4在空气中都能长期存放
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 22.4L CO2与足量Na2O2完全反应,转移电子数为2NA
B. 6.4 g 由S2、S4、S8组成的混合物含硫原子数为0.2NA
C. 1mol/L的NaCl溶液中Cl—的数目为NA
D. 标况下,22.4L NO和11.2L O2,混合后气体分子数为NA
难度: 困难查看答案及解析
-
关于0.1 mol/L H2SO4溶液的叙述错误的是( )
A. 从1L该溶液中取出100mL,则取出溶液中H2SO4的物质的量浓度为0.01 mol/L
B. 0.5 L该溶液中氢离子的物质的量浓度为0.2 mol/L
C. 1 L该溶液中含有H2SO4的质量为9.8 g
D. 取该溶液10mL,加水稀释至100mL后H2SO4的物质的量浓度为0.01mol/L
难度: 中等查看答案及解析
-
摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为
B. c 可表示为
C. ω%可表示为
D. ρ可表示为
难度: 中等查看答案及解析