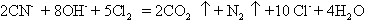-
氰化钠(NaCN)是一种重要的化工原料,在工业上有许多用途。NaCN有剧毒,含氰废水的工业处理流程如图所示。

已知:Ka(HCN)< Ka(CH3COOH),[Ag(CN)2]-(aq) Ag+(aq)+2CN-(aq)。
Ag+(aq)+2CN-(aq)。
(1)氰化钠遇水会产生剧毒氢氰酸,写出该反应的离子方程式:_____________________________。
当物质的量浓度相同时,CH3COOH中水电离出的c(H+)_____________(填“大于”、“小于”或“等于”)HCN中水电离出的c(H+)。
(2)向发生塔中通入水蒸气的目的是____________________________________________________。
(3)氧化池中,C1O2可将CN-氧化。且产生两种无毒气体,当反应过程中转移了 6.02×1023个电子时,生成标准状况下气体的总体积是_____________L。
(4)氧化池中,也可用H2O2代替C1O2,反应后生成一种能使红色石蕊试纸变蓝的气体和一种常见的酸式盐,写出该反应的离子方程式:_______________________________________________________。
(5)电镀厂电镀银时需要降低镀层金属的沉积速率,使镀层更加致密。若电解液使用Na[Ag(CN)2]溶液,则阴极反应式为__________________________________________;解释工业电镀中使用氰离子(CN-)的原因:_______________________________________。
-
氰化钠化学式为NaCN,白色结晶颗粒或粉末,易潮解,易溶于水,有微弱的苦杏仁气味,剧毒,皮肤伤口接触、吸入、吞食微量可中毒死亡,是一种重要的化工原料,用于电镀、冶金和有机合成医药、农药及金属处理方面。试回答下列问题:
(1)NaCN中C元素显________价,N元素显________价。
(2)在微生物的作用下,CN-能够被氧气氧化,生成碳酸氢钠和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性,写出上述反应的离子方程式____________。
(3)用硫代硫酸钠也可处理含CN-的废水,反应的离子方程式为CN-+S2O32-=A+SO32-,A为_____________(填化学式)。
(4)白磷有毒,能和氯酸溶液发生氧化还原反应:3P4+10HClO3+18H2O=10HCl+12H3PO4,该反应的氧化剂是________,还原产物是________,若有1mo1 P4参加反应转移电子数为________。
-
氨是重要的工业原料,其可以用来合成氮肥,某氮肥厂氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:
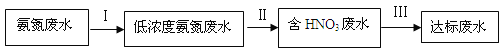
请回答下列问题:
(1)过程1中加入氢氧化钠,写出其中发生的离子方程式____________________
(2)写出氨分子的结构式______;指出分子中化学键是_____(填‘离子键’或‘共价键’)。
(3)过程Ⅱ:在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。其中第一步反应的能量变化示意图如图:
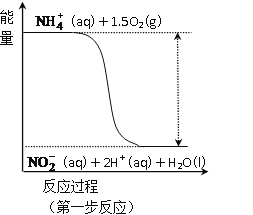
第一步反应是_______反应(选填“放热”或“吸热”),判断依据是_______________。
-
氰化物有剧毒,我国工业废水中氰化物 的最高允许排放浓度为0.5 mg/L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化。发生的反应为:
的最高允许排放浓度为0.5 mg/L;对废水中CN-的处理方法是:在碱性条件下,用Cl2将废水的中CN-转化成N2和CO2等,使废水得到净化。发生的反应为: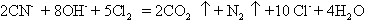
下列有关说法正确的是
A.上述反应中氧化剂是CN-
B.现取1 L含CN-1.02 mg/L的废水,至少需用4.0×10-5mol Cl2处理后才符合排放标准
C.若上述反应生成0.4 mol CO2,则溶液中阴离子增加的物质的量为2 mol
D.当有0.4 mol CO2生成时,反应中转移的电子的总数目约为2×6.02×1023
-
氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
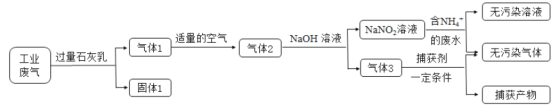
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、__________(填化学式)。
(2)若实验室需要配制3 mol·L-1NaOH溶液1L进行模拟测试,需称取NaOH固体质量为__________g。
(3)用NaNO2溶液处理含NH4+废水反应的离子方程式为__________。
(4)验证废水中NH4+已基本除净的方法是___________(写出操作、现象与结论)。
(5)气体1转化为气体2时空气不能过量的原因是__________。
(6)捕获剂捕获的气体主要是__________(填化学式)。
(7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是__________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
-
氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
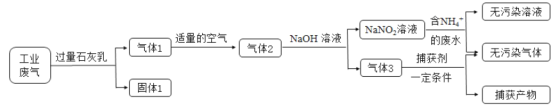
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、__________(填化学式)。
(2)若实验室需要配制3 mol·L-1NaOH溶液1L进行模拟测试,需称取NaOH固体质量为__________g。
(3)用NaNO2溶液处理含NH4+废水反应的离子方程式为__________。
(4)验证废水中NH4+已基本除净的方法是___________(写出操作、现象与结论)。
(5)气体1转化为气体2时空气不能过量的原因是__________。
(6)捕获剂捕获的气体主要是__________(填化学式)。
(7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是__________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
-
氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含NH4+废水和工业废气(主要含NO、CO、CO2、SO2、N2)的流程如图:
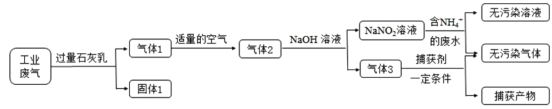
已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体1的主要成分有Ca(OH)2、_______(填化学式)。
(2)用NaNO2溶液处理含NH4+废水反应的离子方程式为____。
(3)验证废水中NH4+已基本除净的方法是________(写出操作、现象与结论)。
(4)气体1转化为气体2时空气不能过量的原因是_________。
(5)捕获剂捕获的气体主要是__________(填化学式)。
(6)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2可以使淀粉变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl。需选用的物质是____(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
-
碳酸氢钠可直接作为制药工业的原料,用于治疗胃酸过多。还可用于电影制片、鞣革、选矿、冶炼、金属热处理,以及用于纤维、橡胶工业等,用途广泛。下列说法正确的是 ( )
A.用碳酸钠等碱性物质处理废水中的酸
B.碳酸氢钠药片是抗酸药,服用时喝些醋能提高药效
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
-
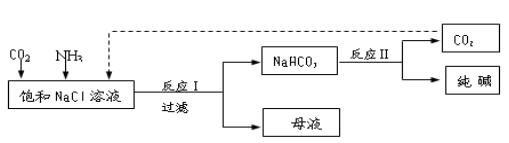
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
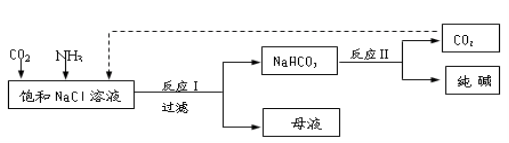
已知NaHCO3在低温下溶解度较小。
反应Ⅰ:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法:
NaHCO3↓+NH4Cl,处理母液的两种方法:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 ___________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
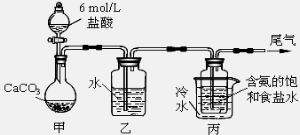
(1)装置丙中冷水的作用是 ;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 ;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
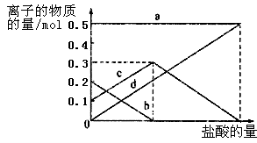
取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。
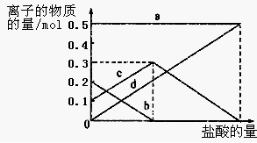
则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是 ; 21
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol•L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
-
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知NaHCO3在低温下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 _____________________________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
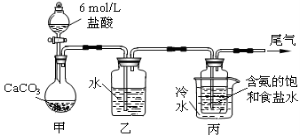
(1)装置丙中冷水的作用是 ;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 ;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是 ;
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol•L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)

Ag+(aq)+2CN-(aq)。