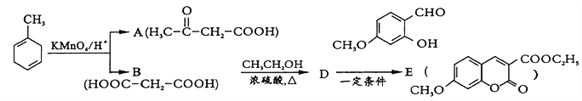
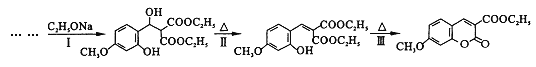
-
《新修本草》是我国古代中药学著作之一,记载药物844种,其中有关于“青矾”的描述:“绛矾,本来绿色,新出窟未见风者,正如瑠璃…烧之赤色…”据此推测,“青矾”的主要成分为( )
A. CuSO4·5H2O B. FeSO4·7H2O
C. KAl(SO4)2·12H2O D. Fe2(SO4)3·9H2O
难度: 简单查看答案及解析
-
化学与生产、生活密切相关,下列有关说法正确的是( )
A. 水玻璃可用于生产黏合剂和防火剂
B. 根据稳定性可将分散系分为溶液、胶体和浊液
C. 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了其强氧化性
D. 高纯度的硅单质可用于制作光导纤维
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol C2H6O分子中含C—H键的数目为0.5NA
B. 1 L 0.1 mol·L-1 NH4Cl溶液中含有的NH4+数目为0.1NA
C. 8.4 g NaHCO3和MgCO3的混合物中含有的阴离子数目为0.1NA
D. 标准状况下,2.24 L Cl2与过量NaOH溶液反应转移的电子数为0.2NA
难度: 中等查看答案及解析
-
分子式为C7H6O2且属于芳香族化合物的同分异构体数目是( )
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 化合物
 的分子式为C13H9O4N2
的分子式为C13H9O4N2B. 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H
OH
C. 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应
D. 甲苯苯环上的一个氢原子被—C3H6Cl取代,形成的同分异构体有9种
难度: 中等查看答案及解析
-
下列实验操作或装置中的药品使用正确的是( )
A. 配制溶液
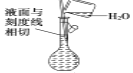 B. 证明非金属性强弱:C>Si
B. 证明非金属性强弱:C>Si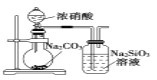
C. 除去CO2 中的HCl
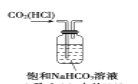 D. 证明SO2 的漂白性
D. 证明SO2 的漂白性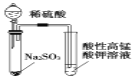
难度: 简单查看答案及解析
-
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
A
浓盐酸
Na2CO3
Na2SiO3溶液
非金属性: C>Si
B
食盐水
电石
溴水
乙炔可与溴发生加成反应
C
浓硝酸
Al
NaOH溶液
铝和浓硝酸反应可生成NO2
D
浓硫酸
Na2SO3
KMnO4酸性溶液
SO2具有还原性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
A. X单质可以通过铝热法获得
B. Y的氧化物是良好的半导体材料
C. Z的氢化物比W的氢化物更稳定
D. X的氧化物和Z的最高价氧化物化合的产物中有共价键和离子键
难度: 中等查看答案及解析
-
用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示。下列说法正确的是( )
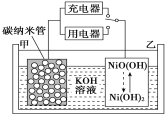
A. 放电时,甲电极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH-
B. 放电时,甲电极为正极,OH-移向乙电极
C. 电池放电时总反应为H2+2NiO(OH)=2Ni(OH)2
D. 充电时,电池的碳电极与直流电源的正极相连
难度: 中等查看答案及解析
-
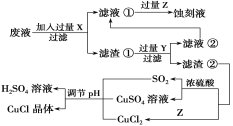
已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
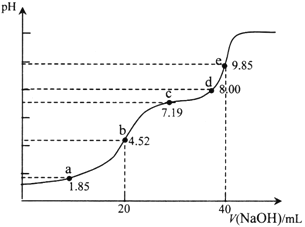
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
难度: 困难查看答案及解析
-
已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式
HA
H2B
电离平衡常数(25 ℃)
Ka=1.7×10-6
K1=1.3×10-3 K2=5.6×10-8
则下列有关说法正确的是( )
A. 等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
B. 将a mol·L-1的HA溶液与a mol·L-1的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
C. 向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA===2A-+H2B
D. NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
难度: 困难查看答案及解析
-
某酸性废水中可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水样品分别进行如图所示①~④四个实验。下列推断正确的是( )
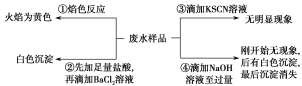
A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
难度: 中等查看答案及解析
-
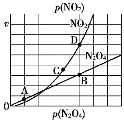
一定温度下,在1 L恒容密闭容器中加入1 mol的N2(g)和3 mol H2(g)发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )
时间/min
0
t1
t2
t3
NH3物质的量/mol
0
0.2
0.3
0.3
A. 0~t1 min,v(NH3)=0.2/t1 mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆向移动
C. N2(g)+3H2(g)
2NH3(g)的活化能小于2NH3(g)
N2(g)+3H2(g)的活化能
D. t3 min时再加入1 mol的N2(g)和3 mol H2(g),反应达到新平衡时,c(N2)>0.85 mol·L-1
难度: 中等查看答案及解析
-
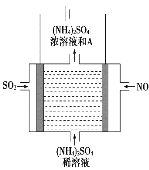
用单质铁去除酸性水体中NO3-的原理如图所示,下列说法错误的是( )
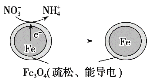
A. 能量转化形式主要为化学能转化为电能
B. 电极材料分别为Fe和Fe3O4
C. 负极反应为NO3-+8e-+10H+===NH4++3H2O
D. 该原理的总反应可表示为NO3-+3Fe+2H++H2O===NH4++Fe3O4
难度: 中等查看答案及解析