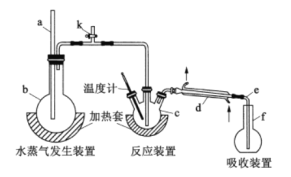
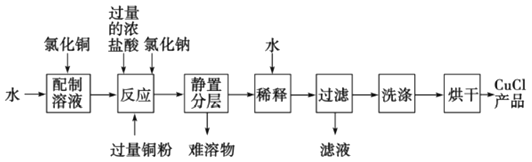
-
化学与生产、生活密切相关,以下有关说法不正确的是
A. 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用
B. 在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料
C. 造纸工艺中使用明矾,会导致纸张发生酸性腐蚀,使纸张变脆,易破损
D. 海水是巨大的资源宝库,可以利用化学方法从海水中提取Br2、Mg、NaCl等物质
难度: 简单查看答案及解析
-
下列化学用语不正确的是
A. N2的电子式:
B. HClO的结构式:H—O—Cl
C. 核内有10个中子的氧原子构成的某种离子:188O22—
D. 醋酸的电离方程式:CH3COOH+H2O
CH3COO−+H3O+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 粗铜精炼中,外电路转移电子数为NA时,阳极质量减小32g
B. 5.6gFe与足量的硫充分反应,转移电子数为0.3NA
C. 室温下,醋酸铵的水溶液呈中性,溶液中所含H+数目为10-7NA
D. S8分子结构如图,1mol该分子中含有S—S键个数为8NA
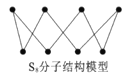
难度: 中等查看答案及解析
-
常温下,下列离子在指定环境中一定能够大量共存的是
A. 通入SO2气体:Na+、Ca2+、Cl-、ClO-
B. 中性溶液中:Mg2+、Fe3+、SO42-、Cl-
C. 0.1mol/L的明矾溶液中:K+、Ba2+、Cl-、HCO3-
D.
mol/L的溶液中:NH4+、Cl-、Fe2+、I-
难度: 中等查看答案及解析
-
用制溴苯的废催化剂(主要含FeBr3及少量溴、苯)为原料,制取无水FeCl3和溴的苯溶液,选用的方法能达到相应实验目的的是
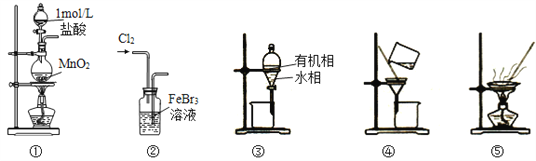
A. 用装置①及其试剂制取氯气
B. 用装置②氧化FeBr3溶液中的溴离子
C. 用装置③分离出FeCl3溶液,不能选用装置④分离
D. 用装置⑤将FeCl3溶液蒸发至干,可得无水FeCl3
难度: 中等查看答案及解析
-
2018年国家文物局对北洋海军军舰“经远舰”进行海上考古,考古队为舰体焊接锌块以实施保护。下列判断不合理的是
A. 焊接锌块后的负极反应:Fe-2e-=Fe2+
B. 上述保护方法中可用镁合金块代替锌块
C. 腐蚀的正极反应:O2+2H2O+4e-=4OH-
D. 考古队采用的是牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
下列实验操作对应的现象或结论正确的是
选项
操作
现象
结论
A
向某滴有酚酞的NaOH溶液中通入SO2
溶液红色褪去
SO2具有漂白性
B
向 H2O2溶液中滴加少量硫酸酸化的FeSO4溶液
溶液变为棕黄色后迅速出现大量气泡
Fe2+催化 H2O2发生分解反应生成O2
C
向相同浓度的Na2CO3、Na2SO4溶液中滴加酚酞
Na2CO3溶液变红、Na2SO4溶液不变红
S的非金属性大于C
D
将相同体积、相同 pH 的盐酸和醋酸溶液稀释a倍、b倍
稀释后溶液pH 值相等
a>b
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W 原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,Z是使用最广泛的短周期金属元素,下列说法不正确的是
A. Y、Z形成的一种化合物强度高、热膨胀系数小,是良好的耐热冲击材料
B. Z的氧化物熔点很高,故工业上常用电解熔融ZW3的方法制取单质Z
C. 离子化合物YX5若存在,YX5与水反应生成气体X2,同时得到一种弱碱溶液
D. 化合物YW3遇水能强烈水解,产物之一具有强氧化性
难度: 中等查看答案及解析
-
科学工作者研发了一种SUNCAT的系统,借助锂循环可持续合成氨,其原理如下图所示。下列说法不正确的是
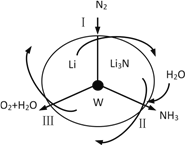
A. 过程Ⅰ得到的Li3N中N元素为-3价
B. 过程Ⅱ生成W的反应:Li3N+3H2O===3LiOH+NH3↑
C. 过程Ⅲ中能量转化的形式:化学能转变为电能
D. 过程Ⅲ涉及到反应:4OH¯-4 e-=== O2↑+2H2O
难度: 中等查看答案及解析
-
以下离子方程式的书写不正确的是
A. 向浓度均为0.1mol/L的NaOH、 Na2CO3的混合溶液中加入足量稀盐酸OH-+CO32-+3H+=2H2O+CO2↑
B. 向含有0.1mol FeBr2的溶液中通入标况下2.24LCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. NH4 Al(SO4)2溶液与过量NaOH溶液:NH4++Al3++5OH-=[Al(OH)4]-+NH3·H2O
D. 向NaHSO4溶液中滴加Ba(OH)2溶液至沉淀完全:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
已知2SO2(g)+O2(g)
2SO3(g),△H=-198kJ/mol,在 V2O5存在时反应过程中的能量变化如图所示。下列叙述正确的是
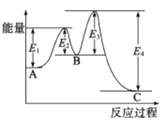
A. △H= E4- E3+E2-E1
B. 加入V2O5后反应经过两步完成,其中第一步决定反应速率
C. 加入V2O5,△H不变,但反应速率改变
D. 向密闭容器中充入2molSO2和1molO2,发生上述反应达平衡时,反应放热198kJ
难度: 中等查看答案及解析
-
已知25℃时有关弱酸的电离平衡常数见下表:
弱酸化学式
HA
H2B
电离平衡常数/ mol/ L
Ka=1.7×10-6
Ka1=1.3×10-3 Ka2=5.6×10-8
则下列说法正确的是
A. 等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
B. 将等浓度的 HA溶液与NaA溶液等体积混合,混合液中:c(A-)<c(Na+)
C. 向 Na2B溶液中加入足量的 HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D. NaHB溶液中部分微粒浓度的关系为:c(Na+)=c(HB-) +c(H2B)+c(B2-)
难度: 中等查看答案及解析
-
25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH 溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH 的关系如图所示。下列说法正确的是
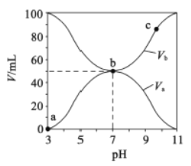
A. 由图可知BOH 一定是强碱 B. Ka(HA)=1×10-6mol/L
C. b点时,c(B-)=c(A-)=c(OH-)=c(H+) D. a→b过程中水的电离程度始终增大
难度: 中等查看答案及解析
-
某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是
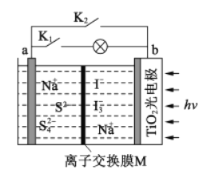
A. 充电时,太阳能转化为化学能,化学能又转化为电能
B. 放电时,a极为正极
C. 充电时,阳极的电极反应式为3I--2e-=I3-
D. M可以使用阴离子交换膜
难度: 中等查看答案及解析
-
Na2SO3溶液中混有 NaHSO3,要提纯Na2SO3溶液,可用三室法电解实现,如图所示。下列说法不正确的是
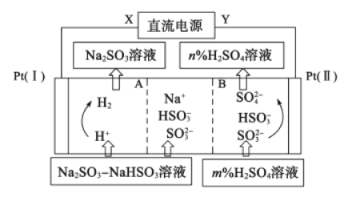
A. A为阳离子交换膜,B为阴离子交换膜
B. X为直流电源的负极,阳极区pH减小
C. 图中的n<m
D. 阴极的电极反应式为2H++2e-=H2↑
难度: 中等查看答案及解析