-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],随着环境酸度的改变n随之改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
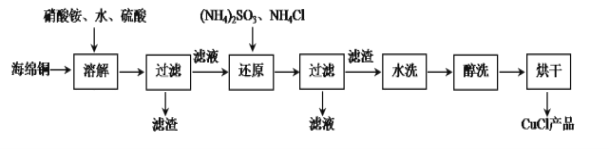
(1)过滤用到的玻璃仪器有烧杯、玻璃棒、________。
(2)还原过程中发生的主要反应的离子方程式:__________,若将(NH4)2SO3换成铁粉也可得到CuCl,写出离子方程式___________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。真空干燥、密封包装的原因是:______________________________。
(4)随着PH值减小[Cu2(OH)4-nCln]中Cu% ________。(填字母)
A. 增大 B.不变 C. 不能确定 D. 减小
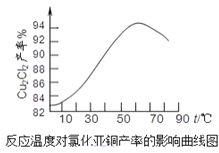
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃ 时,CuCl产率会下降,从生成物的角度分析,其原因可能是_____。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:______。
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)3Cl]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
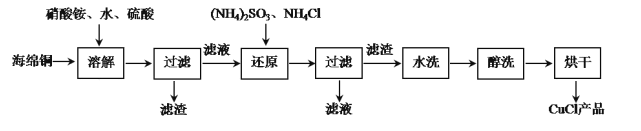
(1)写出溶解过程中发生的氧化还原反应的离子方程式:_________
(2)还原过程中发生的主要反应的离子方程式:_________。
(3)析出的CuCl晶体水洗后要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2h,冷却密封包装。70℃真空干燥、密封包装的原因是__________。
(4)写出氯化亚铜在空气中被氧化的化学方程式________
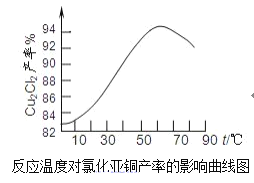
(5)如图是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图可知,溶液温度控制在60℃时,CuCl产率能达到94%,当温度高于65℃时,CuCl产率会下降,其原因可能是___。
(6)以碳棒为电极电解CuCl2溶液也可得到CuCl,写出电解时阴极上发生的电极反应式:____
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业。查阅资料得知:CuCl是一种白色固体,微溶于水,不溶于酒精,能溶于浓盐酸,其熔融物导电性很差。
(1)CuCl为__________(填“共价化合物”或“离子化合物”)。
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)________Ksp(CuCl)(填“>”、“<”或“=”=)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓) 2HCuCl2(无色)
2HCuCl2(无色) 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
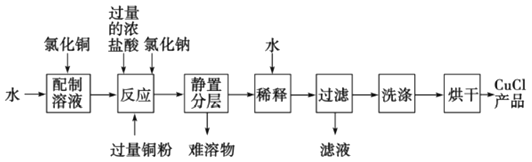
①上述反应流程中,加入氯化钠的目的是________________________。
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O CuOH+H+的平衡常数为:________
CuOH+H+的平衡常数为:________
③为得到纯净的CuCl晶体,最好选用__________(填编号)试剂进行洗涤。
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为__________。实验时,若用2mL0.5mol/L的CuCl2 溶液,最终可得到产品0.16g,则实验的产率为__________。
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质是微溶于水的白色固体,露置于空气中易被氧化为绿色的碱式氯化铜(Cu2(0H)3Cl),在热水中易水解生成氧化铜水合物而呈红色.以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程如图1.

已知Ksp:CuCl:1.2×10-4 CuOH:1.4×10-15 Cu (OH) 2:1.6×10-10
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式:______.
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5.这样做的目的是______.
(3)图2是各反应物在最佳配比条件下,反应温度对CuCl产率影响.由图2可知,溶液温度控制在______时,CuCl产率能达到94%,随后随温度升高CuCl产率会下降,其原因是______.
(4)若要提高Cucl的产率你认为还可采取的措施有______.
(5)写出氯化亚铜在空气中被氧化的化学方程式______.
(6)反应①也可用铁代替亚硫酸钠,写出该反应的化学方程式______.
-
Ⅰ.氯化亚铜( )是一种重要的化工产品,常用作有机合成催化剂, 还可用于颜料, 防腐等工业。 该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知 pH 为 5 时,+2 价铜已开始以碱式盐的形式沉淀。 某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:
)是一种重要的化工产品,常用作有机合成催化剂, 还可用于颜料, 防腐等工业。 该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知 pH 为 5 时,+2 价铜已开始以碱式盐的形式沉淀。 某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:

(1)反应①符合绿色化学思想,且 A 为难挥发性酸,B 为气体,则加入的 A 是_______,通入的 B是______________。 (均写名称)
(2)反应②的离子方程式是___________。 为提高 的产率,常在反应②的溶液中加入适量稀碱溶液但体积不能偏大,往往控制PH为3.5.这样做的目的是_________________。
的产率,常在反应②的溶液中加入适量稀碱溶液但体积不能偏大,往往控制PH为3.5.这样做的目的是_________________。
(3) 最后得到的氯化亚铜需要_______________保存。
Ⅱ.回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境。
(4)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等。 烟灰的回收利用工艺如下:

①“一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以________(填化学式)残留在浸
出渣中,“沉铜”可得到单质铜,该步骤应加入的试剂是__________________________。
② 从贵金属阳极泥中可提取粗银。 电解法精炼粗银时采用 和
和 的混合液作电解液,阴极的主要电极反应式为_______。 阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______________________________。
的混合液作电解液,阴极的主要电极反应式为_______。 阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为_______________________________。
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。已知pH为5时,+2价铜已开始以碱式盐的形式沉淀。某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:


⑴ 加入的A是________,通入的B是________。
⑵ 反应②的离子方程式是________。为提高Cu2Cl2的产率,常在反应②的溶液中加入适量稀碱溶液,控制pH为3.5。这样做的目的是________。
⑶ 保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如下图所示。则溶液温度控制在________时,Cu2Cl2的产率已达到94%,当温度高于65℃时,Cu2Cl2产率会下降,其原因可能是________。
-
氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业.该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色.已知pH为5时,+2价铜已开始以碱式盐的形式沉淀.某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示了处理废料的综合利用方案:

(1)加入的A是________,通入的B是________.
(2)反应②的离子方程式是________.为提高Cu2Cl2的产率,常在反应②的溶液中加适量稀碱溶液,控制pH为3.5.这样做的目的是________.
(3)保持各反应物的最佳配比,改变温度,测得Cu2Cl2产率的变化如图二所示.则溶液温度控制在________时,Cu2Cl2的产率已达到94%,当温度高于65℃时,Cu2Cl2产率会下降,其原因可能是________.
-
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
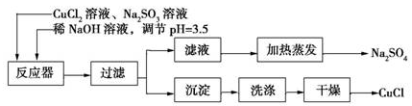
(1)上述方法制备氯化亚铜的化学方程式为_________________ 。
。
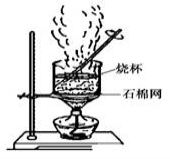
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。
(3)洗涤产品氯化亚铜沉淀的试剂是___________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收 一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
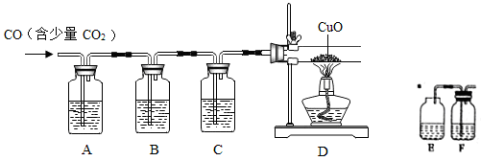
装置A中盛装的是饱和NaOH溶液,该装置的作用是_____________,装置B盛有澄清的石灰水,其中装置B的作用是___________,盛装CuCl的盐酸溶液的装置是____________(选填装置中提供的装置字母代号)。
-
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:
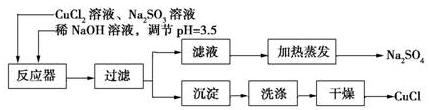
(1)上述方法制备氯化亚铜的化学方程式为_________________。
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。
(3)洗涤产品氯化亚铜沉淀的试剂是____________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。

装置A中盛装的是饱和NaOH溶液,该装置的作用是______________,装置B盛有澄清的石灰水,其中装置B的作用是_____________,盛装CuCl的盐酸溶液的装置是__________(选填装置中提供的装置字母代号)。
-
CuCl常用于有机合成催化剂,并用于颜料、防腐等。工业上以黄铜矿 主要成分是
主要成分是 ,含有少量
,含有少量 为主要原料制备CuCl的主要流程如下:
为主要原料制备CuCl的主要流程如下:
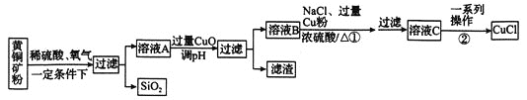
已知:CuCl难溶于水和乙醇,在空气中易被氧化,在水溶液中存在平衡: 白色
白色 无色溶液
无色溶液 。
。
回答下列问题:
 滤渣的主要成分是________
滤渣的主要成分是________ 填化学式
填化学式 。
。
 溶液A中含有硫酸铜、硫酸铁,则在一定条件下黄铜矿与稀硫酸、氧气发生反应的化学方程式为_____。
溶液A中含有硫酸铜、硫酸铁,则在一定条件下黄铜矿与稀硫酸、氧气发生反应的化学方程式为_____。
 ①中发生反应的离子方程式为_________,当观察到__________现象,即表明反应已经完全。
①中发生反应的离子方程式为_________,当观察到__________现象,即表明反应已经完全。
 ②中的一系列操作是________。
②中的一系列操作是________。
 已知:常温下
已知:常温下 ,
, 。若溶液A中
。若溶液A中 ,加入氧化铜
,加入氧化铜 忽略溶液体积变化
忽略溶液体积变化 ,使溶液中
,使溶液中 恰好沉淀完全,此时是否有
恰好沉淀完全,此时是否有 沉淀生成_______
沉淀生成_______ 列式计算
列式计算 。
。 已知:溶液中离子浓度
已知:溶液中离子浓度 时可认为沉淀完全
时可认为沉淀完全 。
。
 工业上还可以利用铜电极电解饱和食盐水制备CuCl,阳极的电极反应式为________。
工业上还可以利用铜电极电解饱和食盐水制备CuCl,阳极的电极反应式为________。
2HCuCl2(无色)
2CuCl↓(白色)+2HCl

CuOH+H+的平衡常数为:________
















