-
化学在生活中无处不在,其中不科学的是
A.含食品添加剂的食品都不属于绿色食品
B.维生素C具有还原性,在人体内起抗氧化作用
C.为防止月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁
D.地震后防疫人员在震区周围撒石灰,其作用是进行环境消毒,防止灾后出现疫情
难度: 简单查看答案及解析
-
不能确定为磷元素的化学用语是

难度: 简单查看答案及解析
-
智利硝石与浓硫酸可用于制硝酸:NaNO3 + H2SO4(浓)
NaHSO4+HNO3↑。该反应说明
A.硫酸比硝酸稳定 B.硫酸的沸点比硝酸高
C.H2SO4 的酸性比硝酸强 D.浓硫酸的氧化性比硝酸强
难度: 简单查看答案及解析
-
利用海水资源能达到相关目标的是
A.用潮汐发电,将化学能转化为电能 B.不需富集,直接提取海水中的溴
C.用海水中的NaCl制取烧碱和纯碱 D.只需使海水中的碘升华就能得到碘单质
难度: 简单查看答案及解析
-
下列判断正确的是
A.氧化物中的氧元素一定呈 - 2价 B.酸性氧化物可能是金属氧化物
C.化学键只存在于晶体中 D.正四面体分子中键角不可能是600
难度: 简单查看答案及解析
-
实验室有关气体的制备实验中不正确的是

难度: 简单查看答案及解析
-
向溶液中通入CO2一定不会产生沉淀的是
A.Ca(OH)2 (aq) B.Ca(NO3)2(aq) C.Na2CO3(aq) D.NaAlO2(aq)
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,失去的电子数为0.3NA
B.11.2 L乙烯(标准状况)里含共用电子对数为NA
C.22.4L CO(g) 与l mol N2(g) 所含的电子数相等
D.100℃时1 L pH=6的纯水中OH- 离子数目为1×10-6 NA
难度: 简单查看答案及解析
-
相关实验现象的描述正确的是
A.钠在Cl2 中燃烧,产生黄色火焰,伴有黄烟
B.向FeCl3(aq)中滴入KSCN(aq),产生红色沉淀
C.Na2O2溶于含有酚酞的水中,溶液先变红后褪色
D.向新制Cu(OH)2浊液中滴入葡萄糖溶液,微热即出现红色沉淀
难度: 简单查看答案及解析
-
每年由于腐蚀造成的钢铁损失约占年产量的10~20%,金属的防腐十分重要。钢铁防腐方法有许多种,图—1与图—2是两个典型的例子。对其中原理的描述正确的是
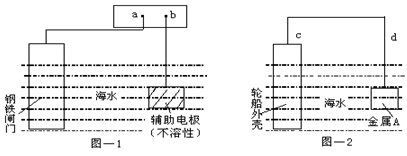
A.图—1:a为电源正极 B.图—1:辅助电极上的反应:O2+4e+2H2O→4OH-
C.图—2:电子流动方向d→c D.图—2:金属A可以是耐腐蚀的金属铜
难度: 简单查看答案及解析
-
正确的实验操作是实验成功的基本保证。下列实验操作正确的是
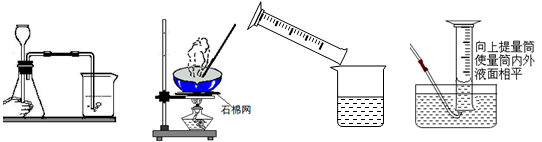
A.检查装置气密性 B.蒸发 C.转移液体 D.读取气体体积
难度: 简单查看答案及解析
-
几种短周期主族元素的结构与性质信息如下表:
元素编号
元素性质或原子结构
T
原子最外层共有6种不同运动状态的电子
X
氢化物水溶液呈碱性
Y
短周期中原子半径最大
Z
元素最高正价是+3价其最高价氧化物可做耐火材料
符合题意的判断是
A.X的气态氢化物一定比T的气态氢化物稳定
B.Y单质与T单质不可直接按原子个数1:1化合
C.常温下Z单质能溶于X最高价氧化物对应水化物的浓溶液中
D.一定条件下元素T或X的氢化物可分别与其氧化物反应生成T或X单质
难度: 简单查看答案及解析
-
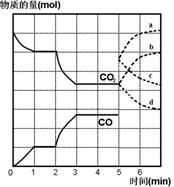
两体积相同的密闭容器中均充入1 mol X和1mol Y,分别于300℃和500℃开始发生反应:
X(g)+Y(g)
3Z(g)。Z的含量(Z%)随时间t的变化如下图所示。已知在t3时刻改变了某一实验条件。相关判断正确的是
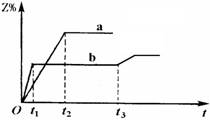
A.曲线a是500℃时的图像 B.正反应是吸热反应
C.t3时刻可能是降低了温度 D.t3时刻可能是增大了压强
难度: 简单查看答案及解析
-
向0.1mol/L的NaOH溶液中慢慢滴加同浓度的醋酸溶液,离子浓度之间的关系不可能出
现的是
A.c(CH3COO-)>c(H+) = c(Na+)>c(OH-) B.c(Na+)>c(OH-) >c(CH3COO-)>c(H+)
C.c(OH-)>c(Na+)>c(H+)>c(CH3COO-) D.c(Na+) >c(CH3COO-)>c(OH-) >c(H+)
难度: 简单查看答案及解析
-
某有机物的结构如图,有关它的说法正确的是
A.分子式为C8H10NO2
B.与Br2 1:1加成最多可得2种产物
C.1mol该有机物最多能与3mol H2发生加成反应
D.它的同分异构体中既属于芳香族化合物又属于α-氨基酸的只有1种
难度: 简单查看答案及解析
-
某澄清透明溶液中可能含有:NH4+、Ba2+、Al3+、Fe2+、SO32-、SO42-、HCO3- 中的几种离子。为确定溶液组成,进行如下实验:
①测定溶液的pH,溶液显强酸性。滴加Ba(NO3)2(aq)出现白色沉淀。
②取少量溶液加入NaOH(aq)至强碱性,产生刺激性气味的气体并得到澄清溶液。
③在②的澄清溶液中通入足量CO2,有白色沉淀生成。 由此,正确的推测是
A.一定有Al3+离子 B.可能有HCO3-离子
C.不能确定SO32-离子是否存在 D.不存在Fe2+离子,可能存在Ba2+离子
难度: 简单查看答案及解析
-
将0.02mol铜片溶于100mL 9mol/L HNO3中,产生336 mL气体(只含NO、NO2)。该气体与一定量O2混合后,用足量NaOH(aq)完全吸收。有关反应如下: NO2+NO+2NaOH→2NaNO2+H2O,2NO2+2NaOH→NaNO3+NaNO2+H2O。 O2的体积至少为(气体体积均为标准状况)
A.67.2 mL B.56.0 mL C.22.4 mL D.11.2 mL
难度: 简单查看答案及解析
-
下图表示198K时N2与H2反应过程中的能量变化。根据下图叙述正确的是

A.该反应的热化学方程式为:
N2(g)+
H2(g)
NH3(g)+92kJ
B.不用催化剂,生成 1molNH3的反应热为46 KJ·mol-1
C.加入催化剂,生成 1molNH3的反应热减小50 KJ·mol-1
D.曲线b表明加入催化剂降低了反应热,加快了反应速率
难度: 简单查看答案及解析
-
在复盐NH4Al(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是
A.NH4++SO42-+Ba2++OH-→ BaSO4↓+ NH3·H2O
B.Al 3++ 2SO42-+ 2Ba2++ 4OH-→ 2BaSO4↓+ AlO2- + 2H2O
C.2 Al 3++ 3SO42-+ 3Ba2++6OH-→ 3BaSO4↓+ 2 Al (OH)3↓
D.NH4++ Al 3++2SO42-+ 2Ba2++ 4OH-→ 2BaSO4↓+ Al (OH)3↓+NH3·H2O
难度: 简单查看答案及解析
-
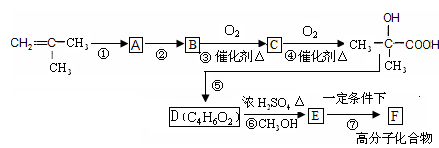
叶蝉散(isoprocard)对水稻叶 蝉和飞虱具有较强的触杀作用,且 残毒低。工业上用邻异丙基苯酚合 成叶蝉散的过程如图, 以下推断正确的是
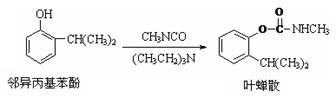
A.邻异丙基苯酚发生了加成反应
B.邻异丙基苯酚发生了取代反应
C.除去叶蝉散中的邻异丙基苯酚可选用Na2CO3(aq)
D.叶蝉散中是否含邻异丙基苯酚可用少量稀溴水检验
难度: 简单查看答案及解析
-
根据下表提供的数据可知能大量共存的微粒组是
化学式
电离常数
CH3COOH
K=1.7×10-5
HClO
K=3.0×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
A.H2CO3 、HCO3-、CH3COO-、ClO-
B.HClO、 HCO3-、CH3COO-、ClO-
C.HClO 、HCO3-、ClO-、CO32-
D.HCO3- 、CH3COO-、ClO-、CO32-
难度: 简单查看答案及解析
-
向MgSO4和Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2溶液,生成的沉淀与加入Ba(OH)2(aq)
物质的量的关系如左图。读图并参考下表,正确的判断是
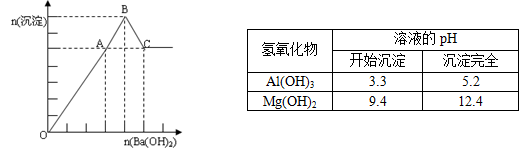
A.OA段可能生成3种沉淀 B.溶液中Mg2+与AlO2- 不能大量共存
C.由图计算可得n(Mg2+): n(Al3+) = 2:1 D.BC段与AB段沉淀的种类可能相同
难度: 简单查看答案及解析