-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究——按如图装置(固定装置已略)进行实验:
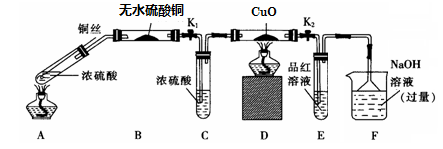
(1)F装置的烧杯中发生反应的离子方程式是 ;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 ;
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 ;
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验II:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 cCu2S+dCuSO4+eH2O。则a∶b= 。
cCu2S+dCuSO4+eH2O。则a∶b= 。
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
| | |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的如下结论中正确是 。
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度 ≥ 15 mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失
-
(15分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:
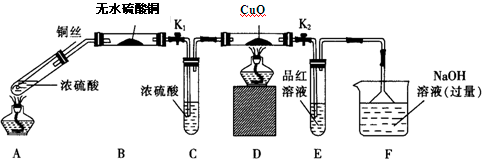
(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+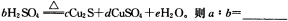
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol· 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知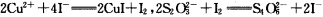 )
)
-
为探究铜与浓硫酸的反应,某兴趣小组进行了如下实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。

(1)、装置A中发生反应的化学方程式为:________
(2)、熄灭酒精灯后,因为有导管存在,B中的液体不会倒吸,其原因是:________。
拆除装置前,不打开胶塞,为了使装置中的残留气体完全被吸收,应当采取的操作是:。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有氧化铜、氧化亚铜、硫化铜、硫化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在空气中充分煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在空气中充分煅烧,均转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如下实验:

(3)、步骤②中检验滤渣是否洗涤干净的实验方法是:。
(4)、固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:
________。
(5)、确定乙是否煅烧完全的操作是:________。
(6)、煅烧过程中一定发生的化学反应方程式为:________。
高氯酸铵(NH4ClO4)是复合火箭推进剂的重要成分,实验室可通过下列反应制取:
NaClO4(aq)+NH4Cl(aq) NH4ClO4(aq)+NaCl(aq)
NH4ClO4(aq)+NaCl(aq)
(7)、用氨气和浓盐酸代替NH4Cl,上述反应不需要外界供热就能进行,其原因是:________
________。
(8)、反应得到的混合溶液中NH4ClO4和NaCl的质量分数分别为0.30和0.l5(相关物质的溶解度曲线如下图)。从混合溶液中获得较多NH4ClO4晶体的实验操作依次为(填操作名称)蒸发浓缩,________,过滤,________、干燥。

为了测定样品中NH4ClO4的含量,装置如上图所示(加热装置、仪器固定装置已略去),实验步骤如下:
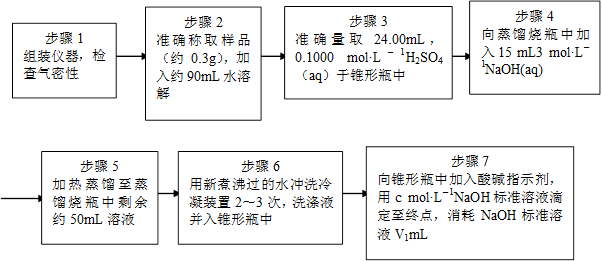
(9)、步骤3中,准确取用24.00 mL H2SO4(aq)的玻璃仪器是________。
(10)、实验中确保生成的氨被稀硫酸完全吸收的实验步骤是________(填写步骤编号)。
(11)、必须重复实验2~3次,其原因是。
(12)、如果0.320 g试样中含NH4ClO4的准确值为0.095g,而实验测定结果是0.092g 。该实验
的相对误差为________。
-
某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示。请回答下列问题:
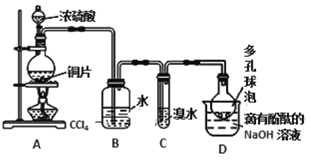
(1)装置B的作用是________________。
(2)装置C中发生反应的离子方程式是_____________________________。
SO2在装置D中完全转化为酸式酸根离子的过程中,溶液颜色变化是________。
(3)已知酸性:HCl>H2SO3>HClO。向Na2SO3溶液中加入盐酸酸化的NaClO溶液时,证明NaClO不足时的试剂是________。
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka大于其水解平衡常数Kh。______________。
-
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如下图所示:
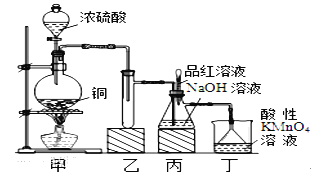
(1)装置甲中发生反应的化学方程式是________________,装置乙的作用是___________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为___________________。
(3)SO2气体有漂白性、还原性和氧化性。将SO2通入溴水中,SO2表现的是__________性,化学反应方程式为_________________________________。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 _____________,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1 mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量1 mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | (空) |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加__________________。 | 若品红褪色(或有气泡),则说明含有Na2SO3。 |
| 步骤3: 用试管取少量A,向其中加入过量___________。 | 若生成白色沉淀,则说明有NaHSO3生成 |
-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)
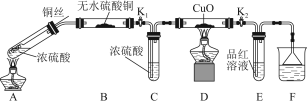
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
-
某化学兴趣小组设计如下实验方案,将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
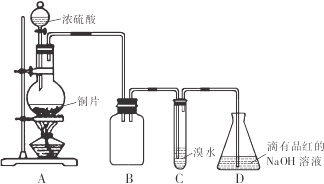
请回答下列问题:
(1)装置B的作用是______。
(2)设计装置C的目的是验证SO2的______性,装置C中发生反应的离子方程式是______装置D中NaOH全部转化为NaHSO3的标志是______。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | _______ | Ⅲ |
| ③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
| ④ | 滴加少量酸性KMnO4溶液、振荡 | 溶液为紫色 | ____ |
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:___。
-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按下图装置(固定装置已略去)进行实验
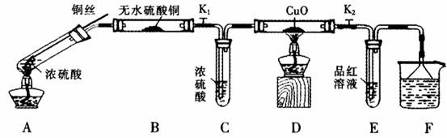
(1)A中反应的化学方程式为: 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(5)某同学想用SO2气体进行喷泉实验(装置如图所示),烧杯中的溶液可以为 (填序号)
a.NaOH溶液 b.饱和NaHSO3溶液 c.氯水 d. KMnO4溶液
实验Ⅱ:反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。
-
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验。请回答:
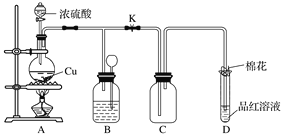
(1)装置A中发生反应的化学方程式:_________。
(2)装置D中试管口放置浸有NaOH溶液的棉花,其作用是______。
(3)装置B中应放置的液体是______。
(4)反应完毕,发现烧瓶中有铜片剩余,下列药品中能用来证明反应结束后的烧瓶中确有余酸的是______(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.NaHCO3溶液
-
(10分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
按下图装置(固定装置已略去)进行实验
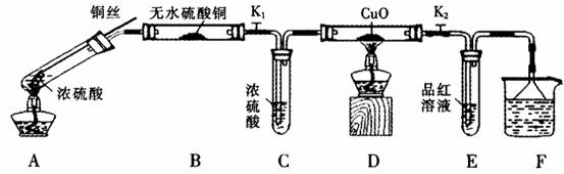
(1)A中反应的化学方程式为:_____________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ反应产物的定量探究
(5)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。


NH4ClO4(aq)+NaCl(aq)




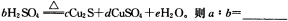
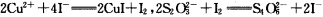 )
)






