-
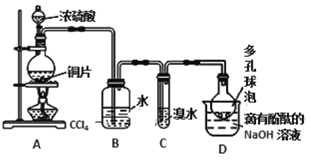
某化学兴趣小组设计实验,用浓硫酸与铜的反应制取SO2并进行相关实验探究,同时获得少量NaHSO3,实验装置如下图所示:
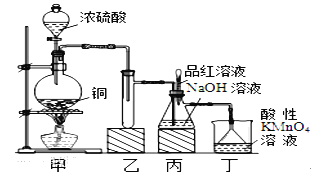
(1)装置甲中发生反应的化学方程式是________________,装置乙的作用是___________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为___________________。
(3)SO2气体有漂白性、还原性和氧化性。将SO2通入溴水中,SO2表现的是__________性,化学反应方程式为_________________________________。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 _____________,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1 mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量1 mol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 | (空) |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再滴加__________________。 | 若品红褪色(或有气泡),则说明含有Na2SO3。 |
| 步骤3: 用试管取少量A,向其中加入过量___________。 | 若生成白色沉淀,则说明有NaHSO3生成 |
-
(11分)为了探究Cl2、SO2同时通入H2O发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
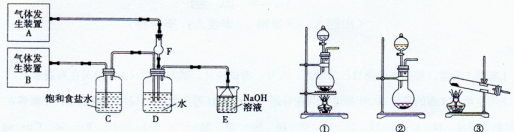
试填空:
(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12 mol·L-1)为原料制取Cl2。在此实验中,F仪器的作用是________;气体发生装置B应选择①、②、③三种装置中的________(选填序号)。
(2)D装置中主要反应的离子方程式为:________。
(3)为验证通入D装置中气体是Cl2过量还是SO2过量,兴趣小组的同!学准备了以下试剂:氯化铁溶液;氯化亚铁溶液;硫氰化钾溶液;苯酚溶液;品红溶液;酸性高锰酸钾溶液。
若Cl2量:取适量D中溶液滴加至盛有________(试剂名称,下同)的试管中,再加入产生的现象是,说明Cl2过量;
若SO2过量:取适量D中溶液滴加至盛有________的试管内,产生的现象是________。
-
某化学兴趣小组设计如下实验方案,将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
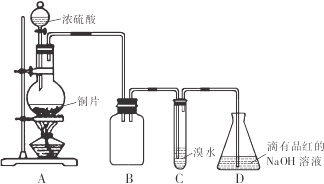
请回答下列问题:
(1)装置B的作用是______。
(2)设计装置C的目的是验证SO2的______性,装置C中发生反应的离子方程式是______装置D中NaOH全部转化为NaHSO3的标志是______。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HClO)
| 序号 | 实验操作 | 现象 | 结论 |
| ① | 加几小块CaCO3固体 | 有气泡产生 | I或Ⅱ |
| ② | 滴加少量淀粉KI溶液,振荡 | _______ | Ⅲ |
| ③ | 滴加少量溴水,振荡 | _________ | Ⅱ |
| ④ | 滴加少量酸性KMnO4溶液、振荡 | 溶液为紫色 | ____ |
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:___。
-
某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如下图所示:
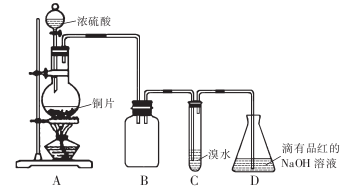
请回答下列问题:
(1)装置B的作用是________________
(2)设计装置C的目的是验证SO2的____________性,装置C中发生反应的离子方程式是____________。装置D中NaOH全部转化为NaHSO3的标志是________________。
(3)向NaHSO3溶液中加入NaCl0溶液时,反应有三种可能的情况:
I.HSO3-与ClO -恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性:H2SO3>H2CO3>HCl0)

(4)请设计简单实验证明:室温下HS03-的电离平衡常数Ka与水解平衡常数Kb,的相对大小:________
-
某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示。请回答下列问题:
(1)装置B的作用是________________。
(2)装置C中发生反应的离子方程式是_____________________________。
SO2在装置D中完全转化为酸式酸根离子的过程中,溶液颜色变化是________。
(3)已知酸性:HCl>H2SO3>HClO。向Na2SO3溶液中加入盐酸酸化的NaClO溶液时,证明NaClO不足时的试剂是________。
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka大于其水解平衡常数Kh。______________。
-
化学兴趣小组为探究铁与浓硫酸反应,设计了如下图所示装置进行实验,回答相关问题.
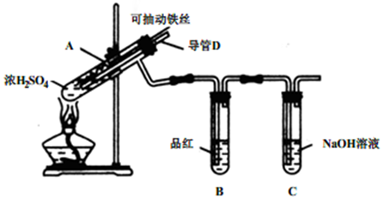
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是:______.
(2)能说明有SO2气体产生的实验现象是______.
(3)反应后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是______.
(4)反应一段时间后,他们对A中溶液的金属离子进行探究,请完成相关问题.
①提出假设:
假设1:只含有Fe3+;
假设2:______;
假设3:既有Fe2+,又有Fe3+.
②设计实验方案验证假设3.在答题卡上写出实验步骤、预期现象和结论.
限选试剂及仪器:稀硫酸、KMnO4溶液、NaOH溶液、淀粉-KI溶液、H2O2溶液
| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管I、II备用 | ______ |
| 步骤二:往试管I中,______ | ______ |
| 步骤三:______ | ______ |
-
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如图所示的实验装置.
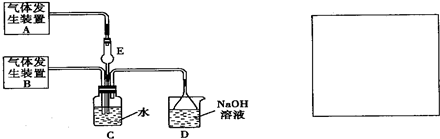
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2.已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是______;发生装置B应选择以下三种装置中的______(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式______.
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在______装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂.
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)⇌SO2Cl2(l)△H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同.
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是______(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
-
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了下图所示的实验装置。
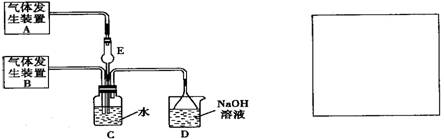
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是
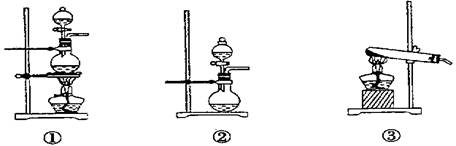
________;发生装置B应选择以下三种装置中的________(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式________。
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在________装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂。
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)  SO2Cl2(l) △H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
SO2Cl2(l) △H= - 97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是________(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是________。
-
为探究Cl2和SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如图所示的实验装置.
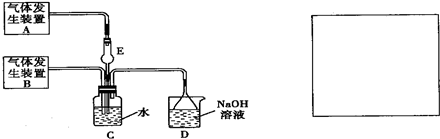
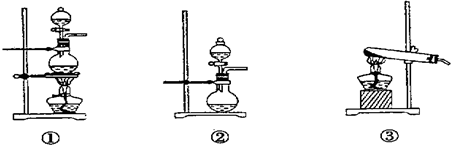
(1)化学兴趣小组的同学采用Na2SO3粉末与70%的硫酸反应制取SO2气体,采用MnO2和浓盐酸反应制取Cl2.已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是______;发生装置B应选择以下三种装置中的______(填序号)
(2)资料显示等物质的量的Cl2和SO2同时通入H2O中恰好反应生成两种酸,请写出反应的离子方程式______.
(3)为了不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在______装置之间(填代号)连接一装置,请在装置图右边的方框中画出简易装置图,并注明装置中盛有的试剂.
(4)已知干燥的SO2和Cl2在活性炭催化剂存在下反应生成液态的SO2Cl2,反应的方程式为:SO2(g)+Cl2(g)⇌SO2Cl2(l)△H=-97.3KJ/mol;SO2Cl2溶于水得到的产物与上述实验结果相同.
①为了提高上述反应中Cl2的平衡转化率,下列说法合理的是______(填序号)
A、缩小容器体积 B、使用催化剂 C、增加SO2浓度 D、升高温度
②已知20℃时,AgCl的溶解度为1.5×10-4g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是______.
-
为了探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组同学设计了图1所示的实验装置。
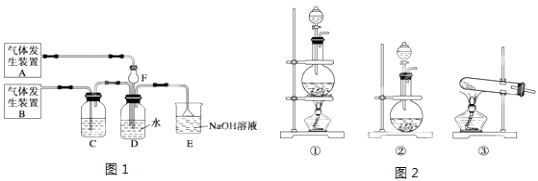
(1)该化学兴趣小组同学为制取Cl2和SO2气体,现采用Na2SO3与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。请写出制取Cl2的离子方程式: 。
(2)在此实验中,F仪器的作用是:______________;发生装置B应选择图2三种装置中的___________(填序号)。
(3)D装置中主要反应的离子方程式为 。
(4)为验证通入D装置中过量的气体是Cl2还是SO2气体,兴趣小组的同学准备了以下试剂:
①氯化铁溶液 ②氯化亚铁溶液 ③硫氰酸钾溶液 ④品红溶液 ⑤溴水 ⑥稀硝酸
A.若Cl2过量:取适量D中溶液滴加至盛有试剂的试管内,发生的现象是: ;(试剂可以多选,请填试剂的序号,下同)。
B.若SO2过量:取适量D中溶液滴加至盛有试剂的试管内,发生的现象是: 。













