-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
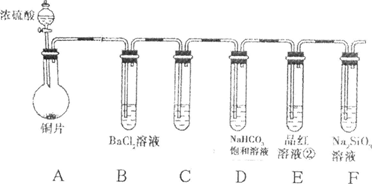
按下图装置(固定装置已略去)进行实验
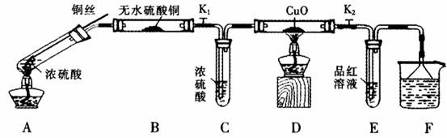
(1)A中反应的化学方程式为: 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(5)某同学想用SO2气体进行喷泉实验(装置如图所示),烧杯中的溶液可以为 (填序号)
a.NaOH溶液 b.饱和NaHSO3溶液 c.氯水 d. KMnO4溶液
实验Ⅱ:反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。
-
(10分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
按下图装置(固定装置已略去)进行实验
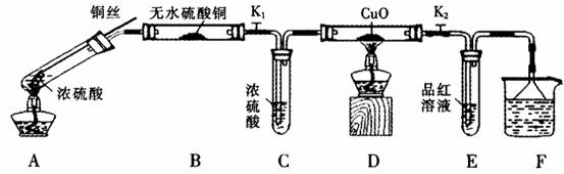
(1)A中反应的化学方程式为:_____________。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ反应产物的定量探究
(5)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。
-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I反应产物的定性探究
按下图装置(固定装置已略去)进行实验
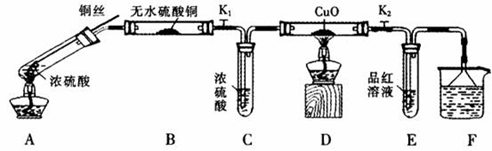
(1)A中反应的化学方程式为:________
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为________ 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:

资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。
仅由上述资料可得出的正确结论是 。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 。 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
-
(15分)为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:
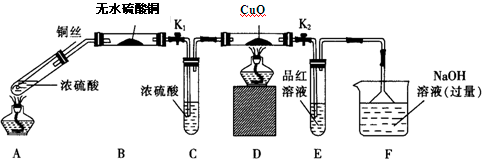
(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+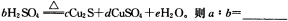
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol· 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知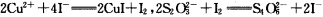 )
)
-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。(固定装置已略去)
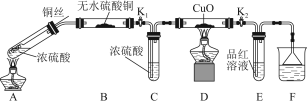
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究——按如图装置(固定装置已略)进行实验:
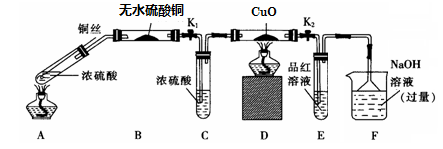
(1)F装置的烧杯中发生反应的离子方程式是 ;
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 ;
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 ;
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验II:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+bH2SO4 cCu2S+dCuSO4+eH2O。则a∶b= 。
cCu2S+dCuSO4+eH2O。则a∶b= 。
(6)为进一步探究该黑色物质的成分,经查阅相关文献获得下列资料。
资料1:
| 硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
| | |
资料2:X-射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的如下结论中正确是 。
A.铜与浓硫酸反应时所涉及的反应可能不止一个
B.硫酸浓度选择适当,可避免最后产物中出现黑色物质
C.该反应发生的条件之一是硫酸浓度 ≥ 15 mol/L
D.硫酸浓度越大,黑色物质越快出现、越难消失
-
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。实验装置如图所示:(固定装置已略去)
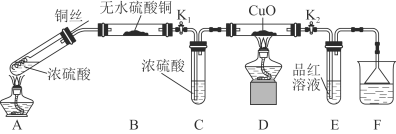
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是  。
。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(6)将57.6g的Cu片加入50mL 18 mol/L的H2SO4溶液中并加热,被还原的H2SO4的物质的量为_________
A.小于0.45 mol
B.等于0.45 mol
C.在0.45 mol和0.90 mol之间
D.等于0.90 mol
-
(13分).Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)
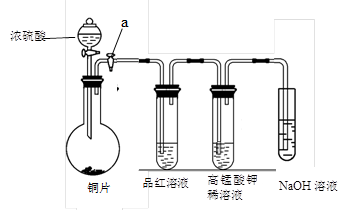
① 连接仪器、、加药品后,打开a,然后滴入浓硫酸,加热。
② 铜与浓硫酸反应的化学方程式是:
________。
③ 从品红溶液中观察到的现象说明SO2具有________性。
④ 高锰酸钾溶液中的实验现象是________。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式________
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | | 有白色沉淀生成,证明待测液中含SO42-。 |
| 步骤② | | |
| 步骤③ | | |
| …… | | |
-
实验I:反应产物的定性探究,按如图装置(固定装置已略去)进行实验:
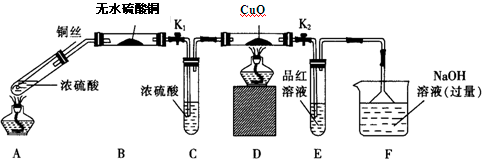
(1)F装置的烧杯中发生反应的离子方程式是 ;B装置中的现象是 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
实验Ⅱ:反应产物的定量探究
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,且黑色物质为Cu2S。产生Cu2S的反应为aCu+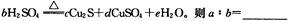
(6)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量 KI溶液中振荡,以淀粉溶液为指示剂,用O.36 mol· 的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
的Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液25.00 mL。若反应消耗铜的质量为6.4 g,则硫酸铜的产率为 。
(已知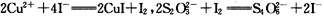 )
)
-
某化学兴趣小组的同学为进行物质性质的探究,用维持烧瓶内压强与分液漏斗内压强相等,使液体能顺利滴下
下图所示装置进行实验。请回答下列问题:(加热及固定装置已略去)
(1)装置A中反应的化学方程式为________
(2)装置C 中的试剂是________( 填序号).
A.氢氧化钠溶液 B. 酸性高锰酸钾溶液 C.亚硫酸氢钠溶液
发生反应的离子方程式为________,其说明了SO2具有________,该实验操作的名称是________。
(3)在上述实验中,能说明碳的非金属性比硅强的实验现象是________
(4)B中的溶液无明显现象,当滴加氯水时有白色沉淀,写出SO2表现还原性并生成白色沉淀的总离子方程式为________

cCu2S+dCuSO4+eH2O。则a∶b= 。






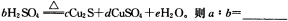
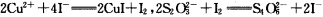 )
)



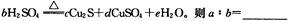
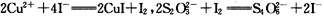 )
)