-
《天工开物》膏液篇,关于提取油脂有如下的叙述,“若水煮法,则并用两釜。将蓖麻、苏麻子碾碎,入一釜中,注水滚煎,其上浮沫即油”。此文中涉及到的下列操作是
A. 分液 B. 蒸发 C. 升华 D. 蒸馏
难度: 简单查看答案及解析
-
化学与生活紧密相连,下列说法错误的是
A. 衣物中的棉、麻、蚕丝灼烧后的产物不同
B. 废弃聚乙烯塑料可重新加工成防水材料或汽油等燃料,变废为宝
C. 生活中用到的碳纤维和光导纤维均为单质
D. 脂肪是有机体组织里存储能量的重要物质
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molCl2溶于水后溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
B. 6.4gCu与足量浓硝酸反应生成NO2分子数目为NA
C. 1mol淀粉(C6H10O5)n水解后产生的葡萄糖分子数目为NA
D. 标准状况下,2molNa2O2与44.8LSO2完全反应,转移的电子数目为4NA
难度: 困难查看答案及解析
-
已知
、
、
(立方烷)的分子式均为C8H8,下列说法正确的是
A. Z的二氯代物有四种
B. X的同分异构体只有Y和Z
C. X、Y、Z中只有X 的所有原子可能处于同一平面
D. X、Y、 Z均可使溴的四氯化碳溶液因发生加成反应而褪色
难度: 中等查看答案及解析
-
将光敏染料(用S表示) 涂在纳米TiO2晶体(可导电) 表面制成其中一个电极,光敏染料可吸收光能将光敏染料S激发成敏化剂S* (高活性光敏材料)后发生下列相关反应:TiO2/S
TiO2/S*(激发态);TiO2/S*- e-→TiO2/S+ 2TiO2/S+ +3I-→2TiO2/S+I3-(注: S和S*不是硫单质,是光敏染料的代号)
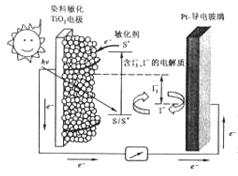
下列关于该太阳能电池叙述错误的是
A. 电池工作时,染料敏化的TiO2 电极为负极
B. 电池工作时,正极发生的反应为I3-+2e-=3I-
C. 电池工作过程中,光敏材料S→S*需要吸收能量,总反应中光敏材料S 不消耗
D. 该电池将光能直接转化为电能
难度: 中等查看答案及解析
-
某实验小组设计如下实验装置(图中夹持装置省略)测定制备的CaCO3粉末的纯度(样品中杂质不与酸反应,反应前装置中的CO2已全部排出)。下列说法错误的是

A. 缓入空气的作用是将反应结束后装置中残留的CO2全部鼓入到C装置中被吸收
B. A装置和D装置都是为了防止空气中的CO2气体进入C 装置而产生误差
C. 为了防止B 中盐酸挥发产生干扰,必须在B、C装置中间加一个装有饱和碳酸氢钠溶液的洗气瓶
D. 若CaCO3样品的质量为x,从C 中取出的沉淀洗净干燥后的质量为y,则CaCO3的纯度为
难度: 困难查看答案及解析
-
某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液(此时不考虑CO32-的水解),滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是
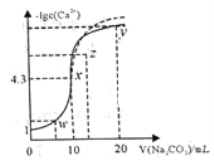
A. z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为w点
C. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
D. 此温度下,Ksp(CaCO3)=1x10-8.6
难度: 困难查看答案及解析
 △H<0
△H<0

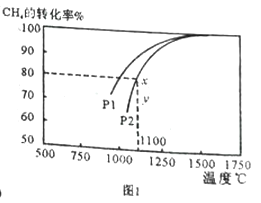
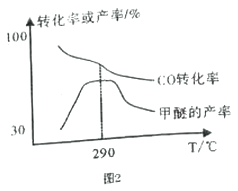

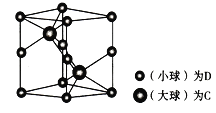

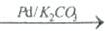 R-C≡C-R´+HBr
R-C≡C-R´+HBr