-
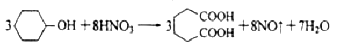
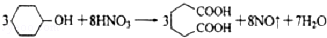
己二酸是一种重要的有机二元酸,能够发生成盐反应、酯化反应、酰胺化反应等,并能与二元胺或二元醇缩聚成高分子聚合物等,是合成尼龙-66的原料,工业上环己醇用硝酸氧化可得到己二酸,是典型的氧化还原反应。
 △H<0
△H<0
相关物理常数:
| 名称 | 相对分子质量 | 密度(20℃) g/cm3 | 熔点(℃) | 沸点(℃) | 溶解度S(g100g溶剂) |
| 水 | 乙醇 | 乙醚 |
| 环己醇 | 100 | 0.96 | 25.2 | 161 | | 可溶 | 易溶 |
| 己二酸 | 146 | 1.36 | 151 | 265 | 可溶(S随温度降低而减小) | 易溶 | 微溶 |
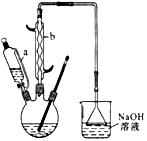
I.己二酸粗产品的制备
操作步骤:装置C中加入50mL中等浓度的硝酸(过量),投入沸石,并逐一安 装装置A、装置B和温度计,磁力搅拌,将溶液混合均匀,并加热到80℃。用装置A滴加2滴环己醇,反应立即开始,温度随即上升到85~90℃,从装置A中小心地逐滴加入环己醇,将混合物在85-90℃下加热2-3 分钟,共加入1.000g环己醇。
请回答下列问题:
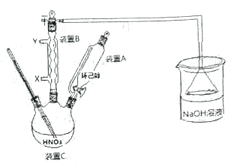
(1)反应需维持温度在85~90℃,最好采取______控温;试分析维持温度在85~90℃的原因:__________。
(2) 装置右侧烧杯中的NaOH 溶液的作用是:_______________。
II.己二酸粗产品的提纯及应用
操作流程:趁热倒出装置C 中的产品,在冷水中降温冷却,析出的晶体在布氏漏斗上进行抽滤,将晶体进行重结晶,再分别用3mL 冰水和乙醚洗涤己二酸晶体,继续抽滤,晶体再用3mL冰水洗涤一次,再抽滤。取出产品,干燥后称重,得干燥的己二酸0.860g。
请回答下列问题:
(3) 相比于普通过滤,抽滤的优点在于:_________
(4)在抽滤过程中,用冰水洗涤析出的己二酸晶体的原因:___________。
(5)该实验的产率为: _______% (结果保留3 位有效数字)
(6)工业上用己二酸与乙二醇反应形成链状高分子化合物,写出化学方程式:________。
-
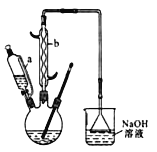
己二酸( )是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
)是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
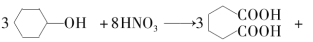 8NO↑+7H2O
8NO↑+7H2O
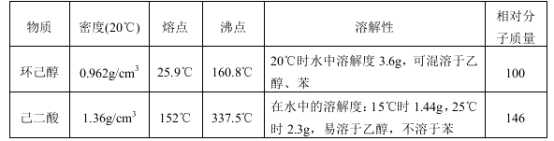
可能用到的有关数据如下:
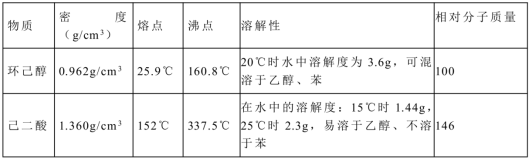
| 物质 | 密度(20 ℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962 g·cm-3 | 25.9 ℃ | 160.8 ℃ | 20 ℃ 时水中溶解度 3.6 g,可混溶于乙醇、苯 | 100 |
| 己二酸 | 1.36 g·cm-3 | 152 ℃ | 337.5 ℃ | 在水中的溶解度:15 ℃ 时1.44 g,25 ℃ 时 2.3 g,易溶于乙醇,不溶于苯 | 146 |
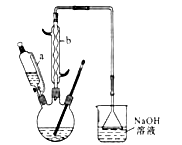
实验步骤如下:Ⅰ.在三口烧瓶中加入 16 mL 50%的硝酸(密度为 1.31 g·cm-3),再加入1~2粒沸石,滴液漏斗中盛放有 5.4 mL 环己醇。Ⅱ.水浴加热三口烧瓶至 50 ℃ 左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60~65 ℃ 之间。Ⅲ.当环己醇全部加入后,将混合物用80~90 ℃ 水浴加热约 10 min(注意控制温度),直至无红棕色气体生成为止。Ⅳ.趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。Ⅴ.粗产品经提纯后称重为 5.7 g。
请回答下列问题:
(1)仪器b的名称为___________________________________________________。
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则,可能造成较严重的后果,试列举一条可能产生的后果:_______________________。
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为2NO2+2NaOH===NaNO2+NaNO3+H2O,NO+NO2+2NaOH===2NaNO2+H2O。如果改用纯碱溶液,吸收尾气时也能发生类似反应,则相关反应方程式为________ 、_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________ 法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
-
(14分)己二酸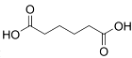 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
可能用到的有关数据如下:
实验步骤如下;
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1) 仪器b的名称为__________。
(2) 向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:
_________________________________________________________________。
(3) 已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:
_____________________________、________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
-
己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下;
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇.
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间.
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止.
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品.V、粗产品经提纯后称重为5.7g.
请回答下列问题:
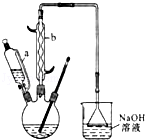
(1)仪器b的名称为 .
(2)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果: .
(3)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为: 、 .
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体.
(5)粗产品可用 法提纯(填实验操作名称).本实验所得到的己二酸产率为 .
-
己二酸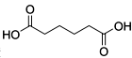 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:


可能用到的有关数据如下:
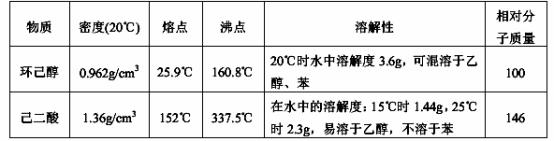
实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1) 仪器b的名称为__________。
(2) 向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:____________________。
(3) 已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O 、NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:____________ _________、___________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
-
己二酸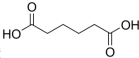 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:

可能用到的有关数据如下:
| 物质 | 密度(20℃) | 熔点 | 沸点 | 溶解性 | 相对分子质量 |
| 环己醇 | 0.962g/cm3 | 25.9℃ | 160.8℃ | 20℃时水中溶解度3.6g,可混溶于乙醇、苯 | 100 |
| 乙二酸 | 1.36g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时,1.44g,25℃时2.3g,易溶于乙醇,不溶于苯 | 146 |
实验步骤如下:
I、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)滴液漏斗的细支管a的作用是_____________,仪器b的名称为_____________。
(2)已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_____________、_____________。
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则。可能造成较严重的后果,试列举一条可能产生的后果:_____________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和_____________洗涤晶体。
(5)粗产品可用_____________法提纯(填实验操作名称).本实验所得到的己二酸产率为_____________。
-
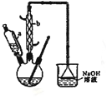
己二酸 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酷化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下: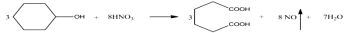
可能用到的有关数据如下:
实验步骤如下:
Ⅰ、在三口烧瓶中加入16mL 50%的硝酸(密度为1.31g/cm),再加入1~2粒沸石,滴液漏斗中盛放有5.4mL环己醇。
Ⅱ、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65 ℃之间。
Ⅲ、当环己醇全部加入后,将混合物用80℃-90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
Ⅳ、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
Ⅴ、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1)滴液漏斗的细支管a的作用是________,仪器b的名称为________。
(2)己知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2 +NaNO3 +H2O
NO+NO2+2NaOH =2NaNO2+H2O;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_________________、__________________;
(3)向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则可能造成较严重的后果,试列举一条可能产生的后果:_________________________ ________。
________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和________洗涤晶体。
(5)粗产品可用________法提纯(填实验操作名称)。本实验所得到的己二酸产率为________。
-
聚酯纤维(Polyesterfiber),俗称“涤纶”,是由有机二元酸和二元醇缩聚而成的聚酯经纺丝所得的合成纤维,属于高分子化合物。以1,3—丁二烯为原料合成PBT纤维的一种合成路线如下:
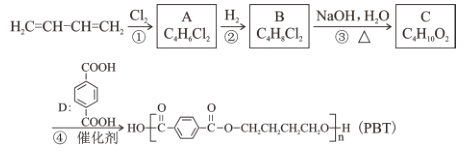
回答以下问题:
(1)A 的官能团有____(填名称), C 的系统命名为_____。
(2)①的反应类型是____。
(3)1,3—丁二烯分子中最多有___个原子共面;1,3—丁二烯与苯乙烯发生1:1 加聚可合成丁苯橡胶,丁苯橡胶的结构简式为___。
(4)反应③的化学方程式为_____;反应④的化学方程式为_____。
(5)物质D有多种同分异构体,符合以下条件的共有____种。
①能发生水解反应② 遇饱和 FeCl3 溶液显色③1 mol 该同分异构体能与足量银氨溶液反应生成 4mo1 Ag
(6)结合上述流程中的信息,设计由乙烯和对苯二甲酸为起始原料制备聚对苯二甲酸乙二醇酯纤维 ( PET ) 的合成路线(无机试剂任选)____________。
-
乙烯是重要的有机合成基础原料。以下是由乙烯合成高分子化合物PVB、缩醛M、碳酸二甲酯等重要有机物的合成路线。
 已知:醛与二元醇可生成环状缩醛:
已知:醛与二元醇可生成环状缩醛: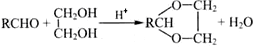
请回答下列问题:
(1)B的名称是______________, C的名称是__________。
(2)反应③的反应类型是_____________,缩醛M的分子式是_____________。
(3)反应④的化学方程式是___________。
(4)D的结构简式是 ___________。
(5)缩醛M有多种同分异构体,其中属于羧酸,且苯环上只有两个取代基的同分异构体共有_______种。
(6)参照的合成路线,设计一条由2-溴丙烷制备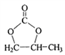 的合成路线(注明必要的反应条件):
的合成路线(注明必要的反应条件):
_________________________________________。
-
羟醛缩合常用于有机合成过程中的增长碳链,其原理为:RCHO+R’CH2CHO
 +H2O(R、R’表示烃基或氢),高分子化合物PVB的合成就是其一种重要应用。
+H2O(R、R’表示烃基或氢),高分子化合物PVB的合成就是其一种重要应用。

已知:Ⅰ.醛与二元醇(如乙二醇)可生成环状缩醛: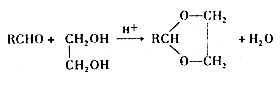
Ⅱ.PCAc的结构为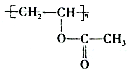 。
。
(1)PVAc由一种单体经加聚反应得到,该单体的结构简式是 。
(2)A的核磁共振氢谱有 组吸收峰。
(3)已知E能使Br2的CCl4溶液褪色,则E的名称为 。
(4)A与 合成B的化学方程式是 。
合成B的化学方程式是 。
(5)若C为反式结构,且由B还原得到,则C的反式结构是 。
(6)N由A经反应①~③合成。
A.①的反应试剂和条件是 。
B.②的反应类型是 。
C.③的化学方程式是 。
 △H<0
△H<0
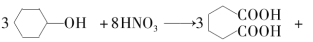 8NO↑+7H2O
8NO↑+7H2O
 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:


 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:

 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:


 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位.实验室合成己二酸的反应原理和实验装置示意图如下:

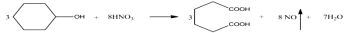



 已知:醛与二元醇可生成环状缩醛:
已知:醛与二元醇可生成环状缩醛: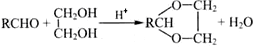
 的合成路线(注明必要的反应条件):
的合成路线(注明必要的反应条件):
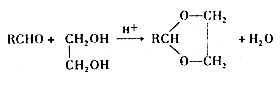
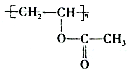 。
。