-
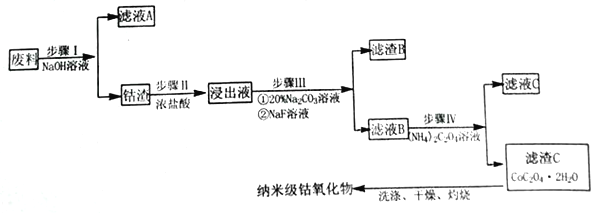
纳米氧化钴在半导体和微电子行业应用广泛,某些金属废料中含有Co元素,从废料(含Co3O4、Al2O3、Li2O、Fe2O3等物质) 中制备高纯度的纳米级钴的氧化物,流程如下
已知:
①LiF 难溶于水,Li2CO3微溶于水;
②钴元素常见的化合价为+2 和+3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中发生的离子反应方程式_______________;
(2)步骤II加浓盐酸的作用是_______________;
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为_______________; 滤渣 B 的主要成分为_________________;
(4)简述如何检验滤液B中是否还有残留的Fe3+:_______________;
(5) 经过反复洗涤、干燥后称重,将质量为3.66gCoC2O4·2H2O进行灼烧,残留固体质量如图所示。

210℃~290℃时若生成两种气体,则发生反应的化学方程式为_______________,400℃~500℃所得固体的化学式为_______________;
-
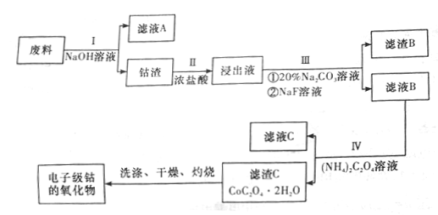
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。现从废料(含Co3O4、Al、Si、Li2O、Fe2O3等物质)中提纯电子级钴的氧化物,其工业制取流程如下:
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)废料在处理前要粉碎,其主要目的是(回答两个方面)___________;
步骤I得到的滤液A中的溶质为___________(填化学式)。
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为_________。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为___________;滤渣B的主要成分为____________。
(4)步骤I、III、IV中均用到的分离提纯方法为_______,在实验室中完成该操作用到的玻璃仪器是__。
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.25 |
| 400~500 | 2.41 |
290℃~320℃时若生成两种气体,则发生反应的化学方程式为___________,400℃~500℃所得固体的化学式为__________。
-
自然界中存在大量的金属元素和非金属元素,它们在工农业生产中有着广泛的应用。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定。
①画出基态Cu原子的价电子轨道排布图____________;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因____________。
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①Cu(NH3)4SO4·H2O晶体中存在的化学键有____________(填字母序号)。
a.离子键 b.极性键 c.非极性键 d.配位键
②SO42—的立体构型是____________,其中S原子的杂化轨道类型是____________。
③已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是__________________。
(3)NaCl和MgO都属于离子化合物,NaCl的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是____________。
(4)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气体中的CO(Ac-代表CH3COO-),该反应是:
[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
[Cu(NH3)3CO]Ac(醋酸羰基三氨合铜)(I) △H<0
①C、N、O三种元素的第一电离能由小到大的顺序为____________;
②配合物[Cu(NH3)3CO]Ac中心原子的配位数为_________。
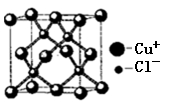
(5)铜的化合物种类很多,右图是氯化亚铜的晶胞结构,已知晶胞的棱长为a cm,则氯化亚铜密度的计算式为:ρ=____________g/cm3(用NA表示阿伏加德罗常数)。
-
钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源、化工等领域。目前工业上使用一种新工艺,以便从冶炼铝的固体废料一赤泥中提取金属钒,赤泥主要含有Fe2O3、Al2O3、V2O5和CuO,具体工艺流程图如下:
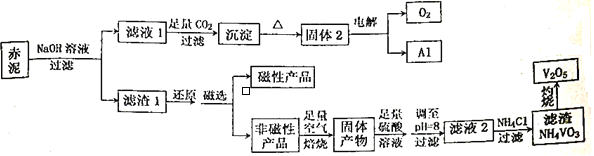
已知:钒有多种价态,其中+5 价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O VO3-+2H+。回答下列问题:
VO3-+2H+。回答下列问题:
(1)磁性产品的化学式为_________________________。
(2)赤泥加入NaOH溶液,发生的离子反应方程式为___________________。能否用氨水代替NaOH溶液,___________(填“能”或“不能”),理由是___________________________________________。
(3)滤液1生成沉淀的离子反应方程式为_________________________________________。
(4)调至pH=8的目的有两个,一是___________________,二是使VO2+转化为VO3-,此时溶液中VO2+和VO3-的物质的量之比为a:b,VO2++H2O VO3-+2H+的平衡常数K=____________________。
VO3-+2H+的平衡常数K=____________________。
(5)滤液2加氯化铵生成NH4VO3的离子方程式为__________________________,该反应能发生是因为__________________________________________。
-
钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源、化工等领域。目前工业上使用一种新工艺,以便从冶炼铝的固体废料一赤泥中提取金属钒,赤泥主要含有Fe2O3、Al2O3、V2O5和CuO,具体工艺流程图如下:
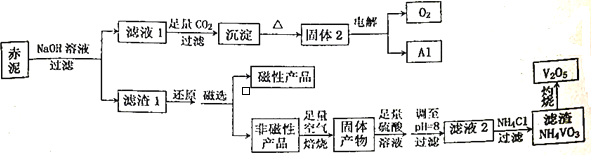
已知:钒有多种价态,其中+5 价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,且存在平衡VO2++H2O VO3-+2H+。回答下列问题:
VO3-+2H+。回答下列问题:
(1)磁性产品的化学式为_________________________。
(2)赤泥加入NaOH溶液,发生的离子反应方程式为___________________。能否用氨水代替NaOH溶液,___________(填“能”或“不能”),理由是___________________________________________。
(3)滤液1生成沉淀的离子反应方程式为_________________________________________。
(4)调至pH=8的目的有两个,一是___________________,二是使VO2+转化为VO3-,此时溶液中VO2+和VO3-的物质的量之比为a:b,VO2++H2O VO3-+2H+的平衡常数K=____________________。
VO3-+2H+的平衡常数K=____________________。
(5)滤液2加氯化铵生成NH4VO3的离子方程式为__________________________,该反应能发生是因为__________________________________________。
-
钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:
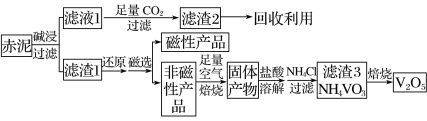
已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以 和
和 的形式存在,且存在平衡VO2++H2O
的形式存在,且存在平衡VO2++H2O VO3-+2H+。下列说法正确的是
VO3-+2H+。下列说法正确的是
A. 工业生产中,碱浸步骤可选用较为廉价的氨水
B. 可以推测VO2Cl溶解度大于NH4VO3
C. 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D. 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
-
钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:

已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以 和
和 的形式存在,且存在平衡VO2++H2O
的形式存在,且存在平衡VO2++H2O VO3-+2H+。下列说法正确的是
VO3-+2H+。下列说法正确的是
A. 工业生产中,碱浸步骤可选用较为廉价的氨水
B. 可以推测VO2Cl溶解度大于NH4VO3
C. 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D. 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
-
钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:
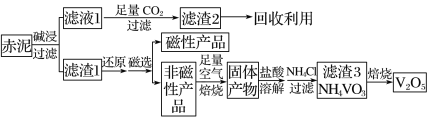
已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以 和
和 的形式存在,且存在平衡VO2++H2O
的形式存在,且存在平衡VO2++H2O VO3-+2H+。下列说法正确的是
VO3-+2H+。下列说法正确的是
A. 工业生产中,碱浸步骤可选用较为廉价的氨水
B. 可以推测VO2Cl溶解度大于NH4VO3
C. 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D. 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
-
自然界中存在大量元素,在工农业生产中有广泛应用。回答下列问题:
(1)人工合成的蓝宝石晶体(Al2O3)是目前半导体工业中应用最广泛的材料。
①基态Al原子中有______种运动状态不同的电子,核外电子占据最高能级的符号是_____,占据该能级电子的电子云轮廓图形状为_______。
②比较第一电高能:Mg______Al(填“>”、”<”或“=”)。在现代化学中,常利用_________上的特征谱线来鉴定元素,称为光谱分析。
(2)羰基硫(COS)存在于许多种植物中,杀虫效果显著。
①1molCOS分子中含有σ键的数目为_____,其中心原子的杂化方式为_____。
②CS2、CO2、COS的分解温度由低到高的顺序为_____。
(3)NaCl 和MgO都属于离子化合物.NaC1的熔点为801.3℃,MgO的熔点高达2800℃。造成两种晶体熔点差距的主要原因是_______________。
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
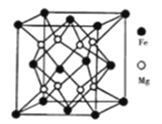
则:①距离一个Fe原子最近的Mg原子个数是______,与此晶胞结构相似的常见的离子晶体是______(填名称)。
②若该晶体储氢时,H2 分子在晶胞的体心和棱心位置,晶胞的参数为dnm,則距离最近的两个H2分子之间的距离为______cm;含铁56g的该储氢合金可储存标准状况下H2 的体积为____L。
-
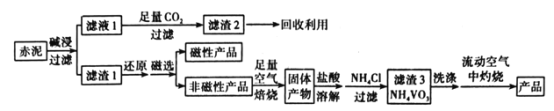
V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:
已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3 V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:___。
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:___。
(3)“洗涤”操作时可选用的洗涤剂有___。(填字母)
A.冷水 B.热水C.1%NH4Cl溶液 D.乙醇
(4)需在流动空气中灼烧的原因可能是___。
(5)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol•L-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
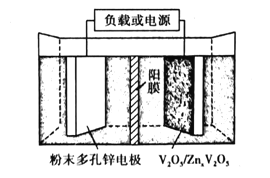
(6)水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为___。