-
化学与生活密切相关。下列说法不正确的是
A. 聚氯乙烯是无毒高分子化合物,属于纯净物
B. 废弃油脂回收后,可以用来制肥皂和甘油
C. 油脂既能提供能量又能促进人体对某些维生素的吸收
D. Fe2O3可用来制作油漆和涂料
难度: 中等查看答案及解析
-
化学实验必须操作规范。下列说法不正确的是
A. 分液漏斗使用前必须要检查是否漏液
B. 蒸发溶液时,要用玻璃棒搅拌溶液
C. 熄灭酒精灯要用灯帽盖灭
D. 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上醋酸溶液
难度: 中等查看答案及解析
-
室温下,在pH =13的无色溶液中,可以大量共存的一组离子是
A. NH4+、K+、NO3-、CO32- B. Na+、Al3+、HCO3-、SO42-
C. Na+、Ba2+、AlO2-、NO3- D. Cu2+、K+、Br-、SO42-
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
C. 向氯化铁溶液中加入过量的硫化钠:2Fe3++S2-=2Fe2++S↓
D. 向石灰乳中加入氯化铁溶液:3Ca(OH)2+2Fe3+=2Fe(OH)3+3Ca2+
难度: 中等查看答案及解析
-
K2FeO4可用作水处理剂,它可由3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O制得。下列说法不正确的是
A. Cl2是氧化剂,Fe(OH)3在反应中失去电子
B. 氧化性:Fe(OH)3 >K2FeO4
C. 每生成l mol氧化产物转移的电子的物质的量为3 mol
D. K2 FeO4的用途与胶体和氧化剂知识有关
难度: 中等查看答案及解析
-
在一个大试管里注入0.0lmol/L碘化钾溶液l0mL,用胶头滴管滴入8—10滴相同浓度的硝酸银溶液,边滴加边振荡,即得碘化银胶体。下列说法正确的是
A. 用上述胶体做电泳实验,发现阳极附近颜色逐渐变深,说明该胶体粒子带负电荷
B. 提纯上述碘化银胶体,需要的实验用品有漏斗、滤纸、烧杯、玻璃棒等
C. 在上述碘化银胶体中快速滴加0.0l mol/L硝酸银溶液至l0mL,将得到更多的胶体
D. 布朗运动是该胶体稳定的主要原因
难度: 中等查看答案及解析
-
下列7种溶液中,通入足量的SO2气体,溶液变浑浊的有
①NazS溶液②Na2SiO3溶液③澄清石灰水④0.1mol/L Ca(ClO)2溶液⑤Ba(NO3)2溶液 ⑥BaCl2溶液⑦酸性KMnO4溶液
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列除去杂质的方法,正确的是
A. 除去Na2CO3;溶液中的少量NaHCO3:加热煮沸
B. 除去MgCl2溶液中的少量FeCl3:加入过量Fe2O3粉末,过滤
C. 除去HC1气体中的少量Cl2:通入CCl4液体,洗气
D. 除去CO2气体中的少量SO2:通入饱和食盐水,洗气
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,11.2 LHCl气体中含有的分子数为0.5NA
B. 常温常压下,5.6 g N2和CO混合物中所含有的原子数为0.4NA
C. 将0.2 mol FeCl3水解制成胶体,所得胶体粒子数为0.2NA
D. 50 mL12 mol/L盐酸与足量MnO2共热,转移电子数为0.3NA
难度: 中等查看答案及解析
-
向1L 0.4mol/L HN03溶液中加入Fe粉和Cu粉的混合物9g,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO3-)为(忽略溶液体积的变化)
A. 0. 2mol/L B. 0.225 mol/L C. 0.3mol/L D. 0.325 mol/L
难度: 中等查看答案及解析
-
下列装置或操作正确且能达到实验目的的是
A. 验证反应的热效应
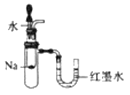 B. 定量测定化学反应的反应速率
B. 定量测定化学反应的反应速率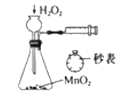 C. 制备并检测氢气的可燃性
C. 制备并检测氢气的可燃性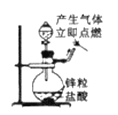 D. 浓硫酸稀释
D. 浓硫酸稀释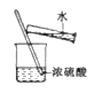
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将红色纸条放入到新制氯水中
纸条褪色
氯气有漂白性
B
将硫酸酸化的H2O2溶液滴入到Fe(NO3)2溶液中
溶液变黄色
H2O2氧化性比Fe3+强
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
铝熔化且滴落下来
铝的熔点较低
D
将NaI溶液加入到AgCl悬浊液中
产生黄色沉淀
Ksp(AgCl)>Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
标准状况下,三个干燥烧瓶分别盛①干燥纯净的氨气、②二氧化氮与氧气的混合气(体积比:V(NO2 ):V(O2 )=4:1)、③一半空气的氯化氢,将它们分别倒置于盛足量水的水槽中,当水进入烧瓶中,并使气体充分溶解,假定烧瓶中溶液无损失,所得溶液的物质的量浓度之比为
A. 5:4:5 B. 1:1:1 C. 15: 12: 10 D. 无法计算
难度: 中等查看答案及解析
-
工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
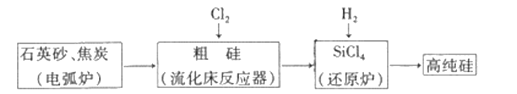
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
难度: 中等查看答案及解析
-
在两个密闭容器甲、乙中,依次充入氧原子数目相同的O2、O3两种气体,若它们的温度和密度均相同。下列说法正确的是
A. 气体体积:甲>乙 B. 气体的质量:甲<乙
C. 气体的分子数:甲<乙 D. 气体的压强:甲>乙
难度: 中等查看答案及解析
-
氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下[以F-12 (二氯二氟甲烷)为例]:
CF2Cl2
CF2Cl+Cl
Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯)
ClOOCl
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率
B. ClO +ClO→ClOOCl的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂
D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
难度: 中等查看答案及解析