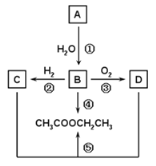
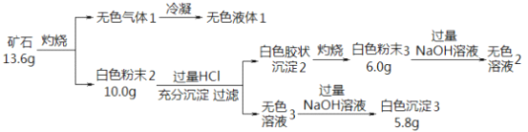
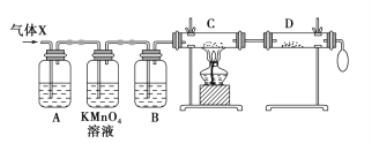
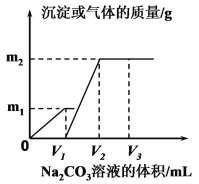
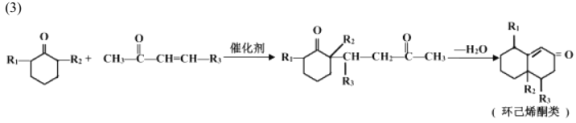
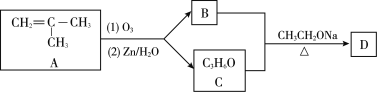
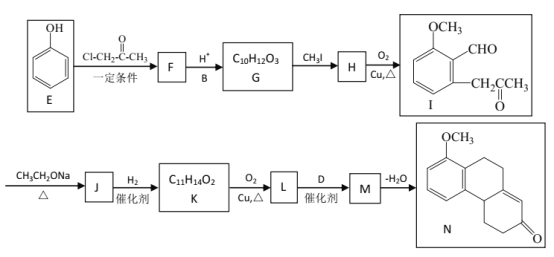
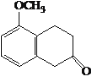
-
下列有水参加反应中,属于氧化还原但水既不是氧化剂也不是还原剂的是
A. CaH2 + 2H2O=Ca(OH)2 + 2H2↑ B. 2F2+2H2O=4HF+O2
C. Mg3N2 + 6H2O=3Mg(OH)2↓+ 2NH3↑ D. 2Na2O2 + 2H2O=4NaOH + O2↑
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
B. 18g D2O和18g H2O中含有的质子数均为10NA
C. 标准状况下,22.4L CHCl3中含有氯原子数目为3NA
D. 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 储热材料芒硝可用于光-化学能的转换
B. 发达国家采用的现代化垃圾焚烧处理法不能有效利用了生活垃圾中的生物质能
C. 利用微生物在光合作用下分解水,是氢气制取的一个重要研究方向
D. 太阳能、可燃冰资源丰富,在使用时对环境无污染或很少污染,且可以再生,是最有希望的未来新能源
难度: 简单查看答案及解析
-
某无色溶液可能含有K+、Na+、NH4+ 、Ba2+、Fe3+、Fe2+、Cl-、Br-、SO32-、SO42-中若干种(忽略水电离出的H+、OH-),且离子浓度相同,依次进行下列实验,且每步所加试剂均过量,观察到现象如下:
①用pH试纸检验,溶液的pH大于7
②向溶液中滴加氯水,再加入CCl4振荡,静置,CCl4层呈橙色
③向所得水溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生过滤,向滤液中加入AgNO3溶液和稀HNO3,有白色沉淀产生
根据上述实验,以下说法正确的是
A. 无法推断原混合溶液中是否含有NH4+和SO42-
B. 原混合溶液中Br-、SO32-肯定存在,Cl-可能存在
C. 确定溶液中是否存在Na+,需要做焰色反应
D. 原混合溶液中阳离子Ba2+、Fe3+、Fe2+一定不存在,K+、Na+、NH4+一定存在
难度: 困难查看答案及解析
-
下列属于碱性氧化物的是
A. NaOH B. CaO C. H2SiO3 D. SO3
难度: 简单查看答案及解析
-
下列仪器名称不正确的是

A. 干燥器 B. 坩埚 C. 三角架 D. 坩埚钳
难度: 简单查看答案及解析
-
下列物质中在一定条件下能够导电,但不属于电解质的是
A. 石墨 B. KNO3 C. H2SO4 D. 蔗糖
难度: 简单查看答案及解析
-
下列物质的水溶液因水解而显酸性的是( )
A. KNO3 B. Fe2(SO4)3 C. Na2CO3 D. H2SO4
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 食品袋中常放生石灰,能起到抗氧化剂的作用
B. NaHCO3固体可以做干粉灭火剂,金属钠着火可以用其来灭火
C. 硫酸可用于化肥、医药、农药的生产,金属矿石的处理
D. 用于电气工业的纯铜可由黄铜矿冶炼直接得到
难度: 简单查看答案及解析
-
下列化学用语表示不正确的是
A. 氢离子结构示意图:
B. 中子数为20 的Ar原子:
C. 二氧化硅的结构式:O=Si=O D. 乙烯的结构简式:CH2=CH2
难度: 简单查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A. 在溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,证明原溶液中有SO42-
B. 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,证明该溶液一定是钠盐溶液
C. 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是SO2
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 硫元素的不同单质S2和S8互为同素异形体
B. CH4与C3H8一定互为同系物
C. 35Cl与37Cl是氯元素的两种核素,互为同位素
D.
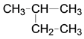 与
与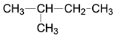 互为同分异构体
互为同分异构体难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,第三周期中Z元素的简单离子半径最小,下列说法不正确的是
X
Y
Z
W
Q
A. Z位于第3周期IIIA族
B. X、Z、W、Q等元素的最高正价等于其所在族的族序数
C. Y元素气态氢化物比W元素的气态氢化物更稳定,是因为前者分子间形成了氢键
D. X的最高价氧化物对应的水化物和X的氢化物形成的化合物含有离子键、共价键
难度: 简单查看答案及解析
-
一定温度下在容积恒定的密闭容器中发生反应A(s)+2B(g)
C(g)+D(g)。下列不能说明反应一定达到化学平衡状态的是
A. v正(B)=2v逆(C) B. 每消耗1molC,同时生成1molD
C. 气体的密度保持不变 D. 容器内压强保持不变
难度: 中等查看答案及解析
-
下列说法正确的是
A. 乙炔在空气中不易完全燃绕,燃烧时冒浓烟
B. 正丁烷与异丁烷的一氯取代物都只有两种,它们的沸点都相同
C. 一定条件下,苯能与液溴反应得到溴苯,反应类型为加成反应
D. 乙烯能使酸性高锰酸钾容液褪色,说明乙烯有漂白性
难度: 中等查看答案及解析
-
下列有关生命活动中的营养物质,说法不正确的是
A. 氨基酸既能与强酸反应,也能与强碱反应
B. 植物油、脂肪与氢氧化钠溶液反应均有醇生成
C. 淀粉、纤维素、蛋白质和油脂都是有机高分子化合物
D. 丝绸与棉布可以通过燃烧闻气味的方法进行鉴别
难度: 简单查看答案及解析
-
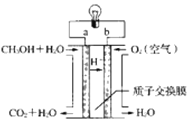
一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是
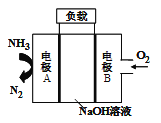
A. 该电池工作时,每消耗22.4L NH3转移3mol电子
B. 电子由电极A经外电路流向电极B
C. 电池工作时,OH-向电极B移动
D. 电极B上发生的电极反应为:O2+ 4H++ 4e-=2H2O
难度: 中等查看答案及解析
-
常温下,浓度均为0.1mol·L-1的盐酸和醋酸,下列说法正确的是
A. 两种溶液的pH:盐酸大于醋酸
B. 用相同浓度的NaOH溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,盐酸消耗的NaOH溶液体积多
C. 向醋酸中加入等物质的量的NaOH,溶液呈碱性,且溶液中
D. 两种溶液中水电离出的氢离子:盐酸大于醋酸
难度: 困难查看答案及解析
-
H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确的是
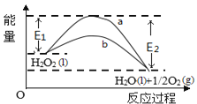
A. 有MnO2 条件下的反应曲线是a曲线
B. 该反应能量变化类型与CaCO3分解反应相同
C. 加催化剂后,正反应速率加快,逆反应速率减小
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= ( E1 - E2 )kJ•mol-1
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 碘单质的升华过程中,只需克服分子间作用力
B. BaCl2属于离子化合物,该晶体中只存在离子键
C. 化学键的断裂与形成一定伴随着电子的转移和能量变化
D. NaHSO4和NaHCO3两种晶体溶于水时,被破坏的作用既有离子键又有共价键
难度: 中等查看答案及解析
-
己知反应:2A(l)
B(l) △H=-QkJ/mol,取等量A分别在0℃和20 ℃下反应,测得其转化率Y随时间t变化的关系曲线(Y-t)如图所示。下列说法正确的是
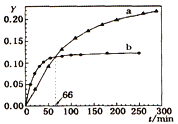
A. a代表20℃下A的Y-t曲线
B. 反应到66min时,0℃和20℃下反应放出的热量相等
C. 0℃和20℃下达到平衡时,反应都放出QkJ热量
D. 反应都达到平衡后,正反应速率a > b
难度: 困难查看答案及解析
-
常温下,现有 0.1 mol·L-1的 NH4HCO3 溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与 pH 的关系如下图所示。下列说法正确的是
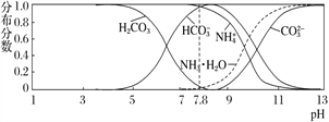
A. 当溶液的 pH=9 时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3 ·H2O)>c(CO32-)
B. NH4HCO3 溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C. 往该溶液中逐滴滴加氢氧化钠时,NH4+和 HCO3-浓度均逐渐减小
D. 通过分析可知常温下 Kb(NH3·H2O)大于 Ka1(H2CO3)
难度: 中等查看答案及解析
-
以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
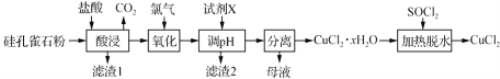
已知: SOCl2+H2O
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
难度: 简单查看答案及解析