-
甲醇被称为21世纪的新型燃料,研究和合成甲醇有着重要的意义。
(1)已知:①H2(g)+1/2O2(g) H2O(l) ΔH1<0;②CO2(g)
H2O(l) ΔH1<0;②CO2(g) CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g) CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
(2)该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g) CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
①下列叙述合确的是__________(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线 ___________________
(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
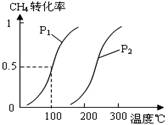
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。
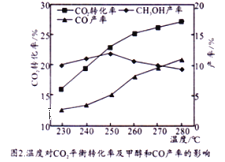
①由图2可知温度升高CO的产率上升,其主要原因可能是__________。
②由图2可知获取CH3OH最适宜的温度是_____。
(4)近几年开发的甲醇燃料电池的工作原理如图所示:
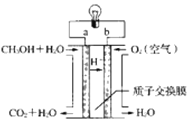
电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为____。
-
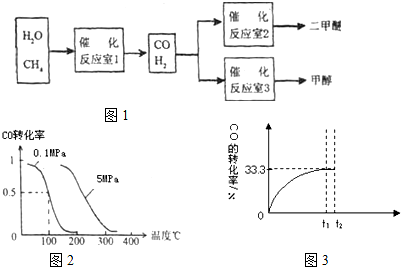
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
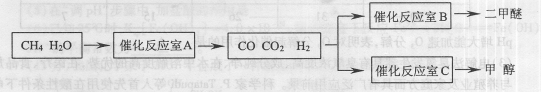
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为________.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为________。
×100%,试求反应(Ⅳ)的原子利用率为________。
②反应(Ⅳ)的△S ________0(填“>”、“=”或“<”)。
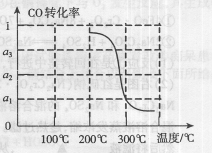
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H________0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= ________(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
-
能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
Ⅰ、已知在常温常压下:① H2O(I)=H2O(g) △H= +44.0 kJ.mol-1
② 2CH3OH(I)十3O2(g)=2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
写出表示甲醇燃烧热的热化学方程式 。
Ⅱ、工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
在体积为2L的合成塔中,充人2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化及甲醇的物质的量随时间、温度变化如下图所示。(T1、T2均大于300℃)
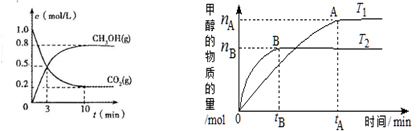
(1) 则上述CO2转化为甲醇的反应的△H1___ _0(填“>”“<”或“=”)。
(2)从反应开始到平衡(10min),用H2表示 的反应速率为__________;
(3)下列说法正确的是 。
A.若保持恒温,当容器中n(CH 3OH)︰n(H2O)为1︰1时,该反应已达平衡状态
B.若保持恒温,当容器内气体压强恒定时,该反应已达平衡状态
C.若其他条件不变,则平衡常数:K(T1)<K (T2)
D.处于A点的反应体系的温度从T1变到T2,达到平衡时 增大
增大
(4)对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 。
A.增加CO2的量 B.升高温度
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
(5)某温度下,将4mol CO和12mol H2,充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为 。
(6)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为A,则容器内的压强与起始压强之比为_____ ___。
-
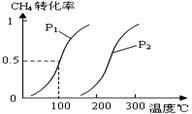
(12分)甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
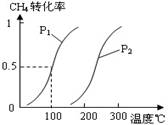
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 ________________。
②图中的P1________P2(填“<”、“>”或“=”),100℃时平衡常数为 ________ 。
③在其它条件不变的情况下降低温度,逆反应速率将________ (填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H________________0,△S________________0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| ⅰ | 150 | 1/3 | 0.1 |
| ⅱ | | | 5 |
| ⅲ | 350 | | 5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。

-
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
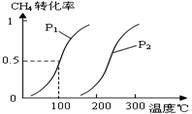
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,
②则用H2表示的平均反应速率为_ 。图中的P1_ _P2(填“<”、“>”或“=”),
100℃时平衡常数为_ _。
③在其它条件不变时降低温度,逆反应速率将_ _(填“增大” “减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。

| l 实验编号 | l T(℃) | l n (CO)/n(H2) | l P(MP) |
| l ⅰ | l 150 | l 1/3 | l 0.1 |
| l ⅱ | l __ | l __ | l 5 |
| l ⅲ | l 350 | l __ | l 5 |
A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
-
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
已知100℃时达到平衡所需的时间为5min,
①则用H2表示的平均反应速率为_ 。
②图中的P1_ _P2(填“<”、“>”或“=”),100℃时平衡常数为_ _。
③在其它条件不变时降低温度,逆反应速率将 _ _(填“增大” “减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
④该反应的△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。
| l 实验编号 | l T(℃) | l n (CO)/n(H2) | l P(MPa) |
| l ⅰ | l 150 | l 1/3 | l 0.1 |
| l ⅱ | l _ _ | l _ _ | l 5 |
| l ⅲ | l 350 | l _ _ | l 5 |

A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
-
二甲醚和甲醇被称为21世纪的新型燃料,以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图1:
I:(1)在一定条件下,容积为 100L密闭容器中发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g);△H>0
将1.0mol CH4和2.0mol H2O(g)通入该密闭容器 l0min时有0.1mol CO生成,则10min内该反应的平均速率v(H2)______.
(2)在压强为0.1MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g)平衡时CO的转化率与温度、压强的关系如图2.
①该反应的△H______0 (填“<”、“>”或“=”).
②100℃时该反应的平衡常数K=______(用含a、V的代数式表示).
③在温度容积不变的情况下,向该密闭容器再增加a mol CO与 2a mol H2,达到新平衡时,CO的转化率______(填“增大”、“减小”或“不变”).平衡常数______(填“增大”、“减小”或“不变”)
④在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的______倍.
II:某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g).CO的转化率随时间变化关系如图2,回答下列问题:
(1)如果一个可逆反应的平衡常数K值很大,下列说法正确的是______(填字母).
A.该反应的反应物混合后很不稳定
B.该反应一旦发生将在很短的时间内完成
C.该反应达平衡时至少有一种反应物的百分含量很小
D.该反应一定是放热反应 E.该反应使用催化剂意义不大
(2)t2时刻向平衡体系中再通入1.0mol H2O(g),请在原坐标图3中将改变这一条件后CO的转化率的变化结果表示出来.
-
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如图所示。
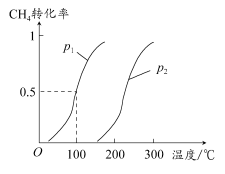
①已知100°C时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________。
②图中的p1________p2(填“<”“>”或“=”),100°C时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的ΔH________0,ΔS________0(填“<”“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| ⅰ | 150 | ½ | 0.1 |
| ⅱ | ________ | ________ | 5 |
| ⅲ | 350 | ________ | 5 |
-
(14分)甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。①CH4(g)+H2O (g)  CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)
CO(g)+3H2(g) △H1 ②CO(g)+2H2(g)  CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
CH3OH(g) △H2 将0.2mol CH4和0.3mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度.压强的关系如图所示:
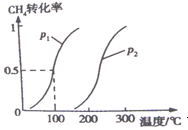
(1)温度不变,缩小体积,增大压强,①的反应速率________(填“增大”.“减小”.“不变”),平衡向________方向移动。
(2)反应①的△H1________0,(填“﹤”“﹦”“﹥”),其平衡常数表达式为K=________,100℃,压强为p1时平衡常数的值是________。
(3)在压强为0.1Mpa条件下,将a mol CO与3a molH2的混合气体在催化剂作用下进行反应②。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下空格中填入剩余的实验条件数据。
| 实验编号 | T℃ | n(CO)/n(H2) | p (Mpa) |
| I | 150 | 1/3 | 0.1 |
| Ⅱ | | | 5 |
| Ⅲ | 350 | | 5 |
(4)近几年开发的甲醇燃料电池是采用铂电极,电池中的质子交换膜只允许质子和水分子通过,其工作原理示意图如下:
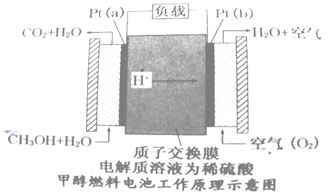
请回答
①Pt(a)电极的电极反应式为
②如果该电池工作时电路中通过2mol电子则消耗的CH3OH有________mol。
-
(13分)
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
② CO(g)+2H2(g)  CH3OH(g) △H2
CH3OH(g) △H2
将0.20mol CH4和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
(1)温度不变,缩小体积,增大压强,①的反应速率________(填“增大”、“减小”或“不变”),平衡向________方向移动。
(2)反应①的△H1________0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是________。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | | | 5 |
| III | 350 | | 5 |
H2O(l) ΔH1<0;②CO2(g)
CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:

CH3OH(g)+H2O(g)
CO(g)+H2O(g)















 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。