-
发射“神六“时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C. N2H4(g) + NO2(g) =3/2N2(g) + 2H2O(l);△H = – 568.35kJ/mol
D. 2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
B. 已知甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═2CO2(g)+2H2O(g)△H=﹣890.3 kJ/mol
C. 已知中和热为△H=﹣57.3 kJ/mol,则含0.5molH2SO4稀硫酸和足量稀Ba(OH)2溶液反应的放出57.3kJ的热量
D. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
难度: 简单查看答案及解析
-
已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1;1/2H2SO4(浓)+NaOH(aq)===1/2Na2SO4(aq)+H2O(l) ΔH2=m,下列说法正确的是
A. 上述热化学方程式中的计量数表示分子数
B. ΔH1>ΔH2
C. ΔH2=-57.3 kJ·mol-1
D. |ΔH1|>|ΔH2|
难度: 中等查看答案及解析
-
下列说法正确的是
A. 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B. 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C. 书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D. 凡是化合反应都是放热反应,分解反应都是吸热反应
难度: 简单查看答案及解析
-
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+1/2O2(g)△H=+242kJ/mol
B. 2H2(g)+O2(g)=2H2O(l)△H=-484kJ/mol
C. H2(g)+1/2O2(g)=H2O(l)△H=+242kJ/mol
D. H2O(g)=H2(g)+1/2O2(g)△H=+484kJ/mol
难度: 简单查看答案及解析
-
充分燃烧一定量丙烷气体放出的热量为xQ,完全吸收它生成的CO2恰好转化成酸式盐需6 mol·L-1的NaOH溶液100 mL,则丙烷的燃烧热为
A. -16xQ B. -5xQ C. -4xQ D. -2xQ
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是(△H的绝对值均正确)
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1367.0 kJ·mol-1(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=+57 kJ·mol-1(中和热)
C. 2NO2=O2+2NO △H=+116.2 kJ·mol-1(反应热)
D. S(s)+O2(g)=SO2(g) △H=-296.8 kJ·mol-1(反应热)
难度: 简单查看答案及解析
-
下列图像分别表示有关反应的反应过程与能量变化的关系。
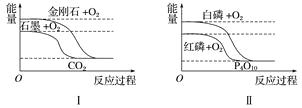
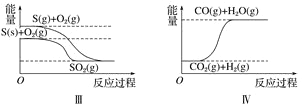
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
难度: 中等查看答案及解析
-
根据合成氨反应的能量变化示意图,下列有关说法正确的是
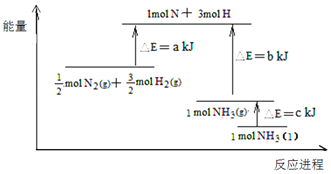
A. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ·mol-1
B. 断裂0.5moIN2 (g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3 (l)= N2(g)+3H2(g) △H=2(b+c-a) kJ·mol-1
D. 若合成氨反应使用催化剂,反应放出的热量增多
难度: 简单查看答案及解析
-
在同温同压下,下列各组热化学方程式中,ΔH1>ΔH2的是
A. 2H2(g)+O2(g)=2H2O(l)ΔH12H2(g)+O2(g)=2H2O(g)ΔH2
B. S(g)+O2(g)=SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2
C. C(s)+1/2O2(g)=CO(g)ΔH1C(s)+O2(g)=CO2(g)ΔH2
D. H2(g)+Cl2(g)=2HCl(g)ΔH11/2H2(g)+1/2Cl2(g)=HCl(g)ΔH2
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
难度: 中等查看答案及解析
-
某化学反应过程的能量变化如图所示。下列说法正确的是
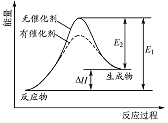
A. 该反应的反应物总能量高于生成物总能量
B. 使用催化剂可以增大该反应的反应热
C. 该化学反应的反应热为E1,且反应放热
D. 化学反应在物质变化的同时,必然伴随能量变化
难度: 中等查看答案及解析
-
以下几个热化学方程式,能表示燃烧热的热化学方程式是
A. C(s)+1/2O2(g)=CO(g)△H=110.5 kJ·mol﹣1
B. C(s)+O2(g)=CO2(g)△H=﹣393.5 kJ·mol﹣1
C. 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6 kJ·mol﹣1
D. H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8 kJ·mol﹣1
难度: 简单查看答案及解析
-
对A+3B=2C+2D来说,下列四种不同情况下的反应速率最快的是
A. υ(A)=0.25 mol/(L·min) B. υ(B)=0.6 mol/(L·min)
C. υ(C)=0.5 mol/(L·min) D. υ(D)=0.6 mol/(L·min)
难度: 简单查看答案及解析
-
A2+B2=2AB的反应历程可以看作如下(△H表示该过程的能量变化):
Ⅰ.A2=A+A △H1
Ⅱ.B2=B+B △H2
Ⅲ.A+B=AB △H3
则下列说法中正确的是
A. 当△H3+(△H1+△H2)>0时,该反应是吸热反应
B. 当2△H3+(△H1+△H2)>0时,该反应是放热反应
C. 当2△H3+(△H1+△H2)<0时,该反应是放热反应
D. 当△H3+(△H1+△H2)<0时,该反应是吸热反应
难度: 中等查看答案及解析
-
下列措施对增大反应速率明显有效的是
A. Na与水反应时增大水的用量
B. 将锌与稀硫酸反应时,向溶液中加入少量CuSO4晶体
C. Fe与稀硫酸反应制取氢气时,改用浓硫酸
D. 用碳还原Fe2O3冶炼铁时,增大碳的用量
难度: 简单查看答案及解析
-
一定量的锌粉和2 mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,能够减小反应速率,又不影响产生H2总量的是
A. 石墨 B. 氧化铜 C. 硝酸钾溶液 D. 氯化钠溶液
难度: 简单查看答案及解析
-
下列两个热化学方程式:
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1;
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2 220 kJ·mol-1。
现有H2和C3H8的混合气体共5 mol,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是
A. 2∶1 B. 3∶1 C. 4∶1 D. 5∶1
难度: 简单查看答案及解析
-
反应4NH3+5O2
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
A. v(NO)=0.1 mol·(L·s)-1 B. v(NO)=0.02 mol·(L·s)-1
C. v(NH3)=0.01 mol·(L·s)-1 D. v(NH3)=0.2 mol·(L·s)-1
难度: 中等查看答案及解析
-
如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
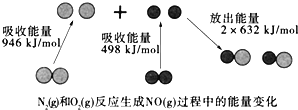
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
难度: 简单查看答案及解析