-
(1)若在常温常压下,l克乙醇完全燃烧生成二氧化碳和液态水放热约为30kJ的热量。写出乙醇燃烧热的热化学方程式________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小关系。
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ/mol,断裂1 mo1H-H键吸收的能量为436kJ,断裂1 molCl-Cl键吸收的能量为247kJ,则形成1 molH-Cl键放出的能量为______kJ。
(3)根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1)△H=-Q1kJ/mol
2H2S(g)+O2(g)=2S(g)+2H2O(1)△H=-Q2kJ/mol
2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-Q3kJ/mol
判断Q1、Q2、Q3三者大小关系:__________。
(4)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)=CH3OH(g) △H=a kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=b kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=c kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为_________________________。
高二化学填空题中等难度题查看答案及解析
-
(1)常温常压下,l mol乙醇完全燃烧生成气态二氧化碳和液态水时,放出1367kJ的热量,写出该反应的热化学方程式________________________。
(2)在一定条件下,向密闭容器中充入一定量的NO2气体,发生如下的反应:
△H<0,达到平衡后,欲使混合气体颜色加深,可采取的措施是____________(填字母代号)
A.加热 B.压缩容器体积 C.加催化剂
(3)写出可逆反应
的平衡常数表达式K=____________。
高二化学解答题简单题查看答案及解析
-
每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应:
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
高二化学填空题简单题查看答案及解析
-
(12分)写出下列反应的热化学方程式
(1)在25℃,101 Kpa 下1 mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为1366.8 kJ,试写出表示乙醇燃烧的热化学方程式:____
(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。已知:N2(g)+2O2 (g)=2NO2(g) △H=+67.7kJ/mol
2N2H4(g)+2NO2 (g)=3N2(g)+4H2O(g)△H= 一1135.7kJ/ mol
则肼完全燃烧的热化学方程式为 。
(3)高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO(g)= Fe(s)+ CO2(g) △H>0。
①此反应的平衡常数表达式为 ;
②温度升高平衡常数K值 (填“增大”、“减小”、或“不变”)
③已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“不是”)处于化学平衡状态,此时化学反应速率是v正 v逆(填“<”、“>”或“=”)。
高二化学填空题中等难度题查看答案及解析
-
(1)常温常压下,依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ。则表示甲醇燃烧热
的热化学方程式为______________________。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量__________________。
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
化学键
键能
化学键
键能
化学键
键能
化学键
键能
C—H
414
C—F
489
H—F
565
F—F
158
H-H
436
H-N
391
①根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
②根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol
-1 计算N≡N的键能。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256kJ的热量(25℃、101 kPa下测得的热量)。
①该反应的热化学方程式为 。
②又已知H2O(l)
=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
高二化学填空题极难题查看答案及解析
-
氢气是一种新型的绿色能源,又是一种重要的化工原料.
(1)氢气燃烧热值高.实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9kJ热量.则H2燃烧的热化学方程式为______.
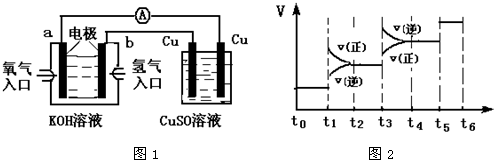
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图1所示实验:
①氢氧燃料电池中,正极的电极反应式为______.
②如图1装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为______L.
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol.
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图2所示.图中t1时引起平衡移动的条件可能是______.其中表示平衡混合物中NH3的含量最高的一段时间是______.
②温度为T℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为______.高二化学解答题中等难度题查看答案及解析
-
(12分)氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高,实验测得,在常温常压下, 1 g H2完全燃烧生成液态水,放出
142.9 kJ热量,则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现将氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,负极的电极反应式为__________________, ②如图实验装置中,某一铜电极的质量减轻3.2 g,则 a极上消耗的O2在标准状况下的体积____________L。
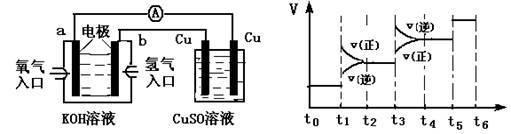
(3)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)
2NH3(g);ΔH=-92.4 kJ/mol,
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示: 图中t1时引起平衡移动的条件可能是_________________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50% ,则反应的平衡常数为____________。
高二化学填空题中等难度题查看答案及解析
-
氢气是一种新型的绿色能源,又是一种重要的化工原料.
(1)氢气燃烧热值高.实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9kJ热量.则H2燃烧的热化学方程式为______.
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景.现氢氧燃料电池进行图1所示实验: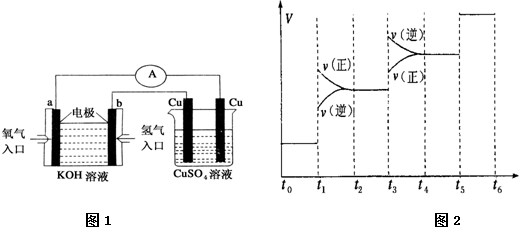
①氢氧燃料电池中,正极的电极反应式为______;
②右图装置中,某一铜电极的质量减轻3.2g,则a极上消耗的O2在标准状况下的体积为______L.
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图2所示.图2中t1时引起平衡移动的条件可能是______,其中表示平衡混合物中NH3的含量最高的一段时间是______,若t-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是______.
②若在恒温、恒压条件下向平衡体系中通入氩气,平衡______移动(填“向左”、“向右”或“不”);使用催化剂反应的△H______(填“增大”、“减小”或“不改变”).
温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为______.高二化学解答题中等难度题查看答案及解析
-
氢气是一种新型的绿色能源,又是一种重要的化工原料.
(1)氢气燃烧热值高.实验测得,在常温常压下,1g H2完全燃烧生成液态水,放出142.9kJ热量.则H2燃烧的热化学方程式为________.
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)⇌2NH3(g);△H=-92.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示.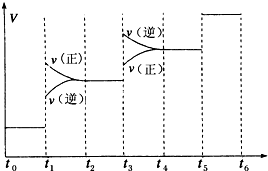
图中t1时引起平衡移动的条件可能是________其中表示平衡混合物中NH3的含量最高的一段时间是________
②温度为T℃时,将2a mol H2和a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%.则反应的平衡常数为________.高二化学填空题中等难度题查看答案及解析
-
氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧热的化学方程式为 ________。
(2)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)
2NH3(g);ΔH=-92.4 kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是________其中表示平衡混合物中NH3的含量最高的一段时间是________

②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为________
高二化学填空题困难题查看答案及解析