-
下列离子方程式正确的是( )
A. Fe3O4固体溶于足量稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O
B. 用小苏打治疗胃酸过多:HCO3﹣+H+═CO2↑+H2O
C. 向溴化亚铁溶液中通入足量氯气:2Br﹣+Cl2═Br2+2Cl﹣
D. 碳酸氢铵溶液与足量澄清石灰水溶液混合:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+CO32﹣+2H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A. CCl4的沸点低于SiCl4,其原因是晶体类型不同
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是共价化合物
C. HClO易分解是因为HClO分子间作用力弱
D. 离子化合物中不一定含有金属元素
难度: 中等查看答案及解析
-
FeCl3溶液吸收H2S的原理:2Fe3++H2S→2Fe2++2H++S↓。下列说法正确的是
A. H2S作氧化剂 B. 还原性:H2S > Fe2+
C. Fe3+ 发生氧化反应 D. 每消耗1mol H2S时转移4NA个电子
难度: 中等查看答案及解析
-
有下列10 种物质,归类正确的是
①铝②H2S ③金刚石 ④氯水 ⑤NaOH 固体 ⑥BaCO3固体 ⑦氨水 ⑧CO2 ⑨乙醇 ⑩盐酸
A. 能导电的物质①④⑤⑦⑩ B. 含有离子键的化合物: ⑤⑥⑩
C. 电解质: ⑤⑥⑩ D. 共价化合物: ②⑧⑨
难度: 中等查看答案及解析
-
有关氧化还原反应的理解正确的是( )
A. 在一定条件下,氯酸钾与碘发生反应KClO3+I2=2KIO3+Cl2 由此判断氧化性 I2>Cl2
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为12 mol
C. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物与还原产物的物质的量比为1:3
D. 在反应CH3CH2OH+K2Cr2O7(H+)→CH3COOH中,每消耗1mol乙醇转移3NA个电子(NA为阿伏伽德罗常数的值)
难度: 中等查看答案及解析
-
下列实验中,所选装置或实验设计合理的是
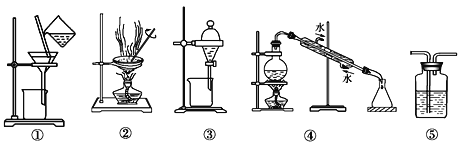
A. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图①和②所示装置进行粗盐提纯
D. 用图④所示装置进行石油分馏实验制取汽油
难度: 中等查看答案及解析
-
下列有关物质的分离说法正确的是
A. 检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作
B. 碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色
C. 可用加热法分离NH4Cl(s)和I2(s)
D. 蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述正确的是
A. 1L 0.1 mol·L-1CH3COOH溶液中含H+的数目为0.1NA
B. 标准状况下.2.24LCl2溶于水,转移的电子数为0.1NA
C. 100g质量分数为46%的酒精溶液中含氧原子总数为4NA
D. 常温下,将1molFe加入足量硝酸中,生成H2的分子数为NA
难度: 中等查看答案及解析
-
配制一定物质的量浓度的稀盐酸,结果偏高的是
A. 在容量瓶中定容时,俯视刻度线
B. 用量筒量取浓盐酸时,俯视刻度线
C. 转移溶液后,未洗涤烧杯和玻璃棒就直接定容
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度线又加水至刻度线
难度: 中等查看答案及解析
-
将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是( )
A. 氧气、干冰、硫酸、烧碱 B. 碘酒、冰、盐酸、烧碱
C. 氢气、二氧化硫、硝酸、纯碱 D. 铜、硫酸钠、醋酸、石灰水
难度: 中等查看答案及解析
-
下列化学反应所对应的离子方程式书写正确的是
A. 醋酸铵与稀盐酸反应:CH3COONH4+H+═CH3COOH+NH4+
B. 氯化铁溶液中通入硫化氢气体:2Fe3++S2-═2Fe2++S↓
C. 硫酸铜溶液中加入过量的氢氧化钡:Ba2++ SO42-═BaSO4↓
D. 溴化亚铁溶液中通入足量的氯气:3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2
难度: 中等查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A. Na+、Ag+、AlO2-、Br- B. H+、Fe2+、SO42-、NO3-
C. K+、NH4+、CO32-、OH- D. Ca2+、Al3+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列各组离子可能大量共存的是
A. 常温下水电离出的c(H+)/c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
B. 能与金属铝反应放出氢气的溶液中:Fe2+、NO3-、Cl-、NH4+
C. 可使石蕊试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2-
D. 0.1mol/LFeCl3溶液中:K+、NH4+、I-、SCN-
难度: 中等查看答案及解析
-
某溶液中只含有Na+, Al3+,Cl-,SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A. 1:2 B. 1:4 C. 3:4 D. 3:2
难度: 中等查看答案及解析
-
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+
Cr3++Fe3++H2O ②,下列有关说法正确的是
A. 还原性:Cr3+>SO2 B. 配平后方程式②中,a=6,b=7
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 方程式①中W为OH-
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A.
向2mL0.1mol/L FeCl3 溶液中加足量铁粉,震荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4NO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4NO3显碱性
D.
向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一只试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)< Ksp(AgCl)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关NH4Cl、PH3、C2H4、Na2O2、CaCl2、SiO2的说法正确的是
A. 含有配位键的是NH4Cl、PH3、Na2O2
B. 含有非极性键的是C2H4、Na2O2、CaCl2
C. 含有极性键的是NH4Cl、PH3、CaCl2
D. 熔化时需克服离子键的是NH4Cl、Na2O2、CaCl2
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 晶体中分子间作用力越大分子越稳定
B. 原子晶体中共价键越强熔点越高
C. 冰融化时水分子中共价键发生断裂
D. 氢氧化钠熔化时离子键、共价键均被破坏
难度: 简单查看答案及解析
-
下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg和金属Cu的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. 邻羟基苯甲醛(
)和对羟基苯甲醛(
)的沸点
D. C-O和Si-O的键能
难度: 中等查看答案及解析
-
已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。
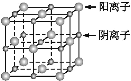
下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
难度: 困难查看答案及解析
 )分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。
)分子中2号碳原子的杂化方式为__________;与CS2互为等电子体的阴离子是__________(写一种)。