-
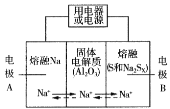
[2017新课标Ⅰ]支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是
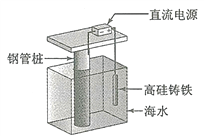
A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
难度: 困难查看答案及解析
-
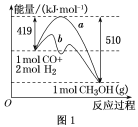
已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),充分燃烧后,放出热量710.0 kJ,并生成液态水。下列说法正确的是
A. CO燃烧的热化学方程式为2CO(g)+O2(g)==2CO2(g) ΔH=−282.8 kJ/mol
B. H2燃烧的热化学方程式为2H2(g)+O2(g)==2H2O(g) ΔH=−571.6 kJ/mol
C. 燃烧前的混合气体中,H2的体积分数为60%
D. 混合气体燃烧后与足量的过氧化钠反应,转移电子2.5 mol
难度: 中等查看答案及解析
-
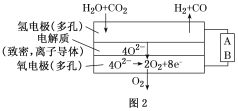
我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法正确的是

A.图中N型半导体为正极,P型半导体为负极
B.图中离子交换膜为阳离子交换膜
C.反应完毕,该装置中电解质溶液的碱性增强
D.人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
难度: 困难查看答案及解析
-
X、Y、Z、W、R是原子序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A. Y、Z、W原子半径依次增大
B. 元素W、Z形成的简单氧化物,W的氧化物熔点更高
C. X、Z、W的最高价氧化物对应水化物两两间均可发生反应
D. W、Z的最高价氧化物对应水化物碱性,W>Z
难度: 中等查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。
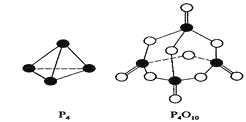
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
难度: 中等查看答案及解析
-
下列有关热化学方程式的书写及对应的表述均正确的是
A. 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量。则Fe(s)+S(s)==="FeS(s)" ΔH=-95.6 kJ·mol-1
B. 稀醋酸与0.1 mol·L-1NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ·mol-1
C. 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. 已知2C(s)+O2(g)=2CO(g)ΔH=-221 kJ·mol-1,则可知C的燃烧热ΔH=-110.5 kJ·mol-1
难度: 中等查看答案及解析
-
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入

A. 0.1 mol CuO
B. 0.1 mol CuCO3
C. 0.05 mol Cu2(OH)2CO3
D. 0.1 mol Cu(OH)2
难度: 困难查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
下列说法不正确的是:( )
A. 由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867 kJ·mol-1
B. 等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等
C. 若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ
D. 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA
难度: 中等查看答案及解析
-
煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)
CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ·mol-1
③催化液化Ⅱ:CO2(g)+2H2(g)
CH3OH(g)+1/2O2(g) ΔH3=a kJ·mol-1
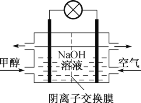
A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、ΔH2都减小
B. 反应C(s)+H2O(g)+H2(g)
CH3OH(g) ΔH=+41.1 kJ·mol-1
C. ΔH2>ΔH3
D. 如图为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+6OH-
CO2↑+5H2O
难度: 困难查看答案及解析
-
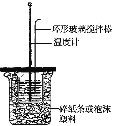
水银法电解食盐水是氯碱工业发展进程中的重要里程碑,以制得碱液纯度高、质量好而著称,其生产原理示意图如下。下列说法不正确的是
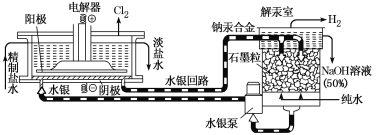
A. 电解器中阳极的电极反应式为2Cl--2e-===Cl2↑
B. 当阳极产生3.36 L(标准状况)气体时,解汞室中生成NaOH的质量为12 g
C. 解汞室中产生氢气的电极为阴极
D. 在直流电作用下,电解器中的Na+变成金属钠,与水银形成钠汞合金,从而与Cl2分开
难度: 中等查看答案及解析
-
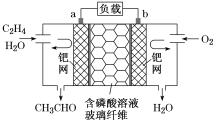
用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是
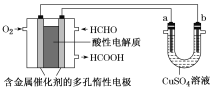
A. 当a、b都是铜作电极时,电解的总反应方程式为2CuSO4+2H2O
2H2SO4+2Cu+O2↑
B. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
C. 当燃料电池消耗22.4 L甲醛气体时,电路中理论上转移2 mol e-
D. 燃料电池工作时,负极反应为HCHO+H2O-2e-===HCOOH+2H+
难度: 中等查看答案及解析
-
用石墨电极完成下列电解实验。下列对实验现象的解释或推测不合理的是
实验一
实验二
装置


现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生;……
A. a、d处:2H2O+2e-=H2↑+2OH-
B. b处:2Cl--2e-=Cl2↑,Cl2溶于水生成HClO,使溶液褪色
C. c处发生了反应:Fe-2e-=Fe2+
D. 根据实验一的原理,实验二中n处能析出O2
难度: 困难查看答案及解析